- Ошибка
- Ошибка
Природные жирные кислоты: источники, структура и биологическая активность
АвторПриводимый ниже материал является переводом некоторых разделов обзора по природным жирным кислотам (www.Cyberlipids.org.). На этом же сайте можно найти разделы по отдельным классам всех известных природных жирных кислотах.
Жирные кислоты (ЖК) связанные с гидроксильными группами глицерина, являются основными составляющими жиров и масел. Промышленная переработка жиров и масел, как для пищевых, так и для технических целей основана на химической модификации карбоксильных групп или двойных связей ЖК. Большинство реакционных центров в ЖК связаны с карбоксильной группой и двойными связями. Карбоксильные группы и ненасыщенные связи, как правило, могут модифицироваться не зависимо друг от друга, но при непосредственной близости друг от друга в некоторых реакциях взаимодействуют друг с другом, например в реакции лактонизация (Imbs et al., Chem. Phys. Lipids 1991, 60, 71). В ферментативных реакциях реакционная способность карбоксильной группы может зависеть от близости расположения первой от нее двойной связи. В настоящее время дана характеристика более 1000 природных индивидуальных ЖК, но для млекопитающих известны около 120-150 (Arts et al., 2001, 58, 122).
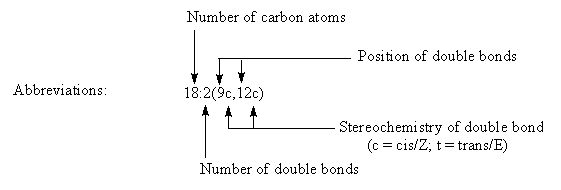
Для описания молекулярных структур ЖК необходимо указать длину углеродной цепи (количество атомов углерода), количество и точное положение двойных связей. Именно двойные связи во многом определяют физические и биологические свойства молекулы ЖК и липидов, в состав которых входят ЖК.
Большинство ЖК являются соединениями с прямой цепью, чаще всего с четным числом атомов углерода. Нечетные ЖК, в основном находящиеся у бактерий и низших растений или у животных, которые связанных с ними пищевыми связями (Rezanka T et al., Prog Lipid Res 2009, 48, 206). Длина цепи ЖК может составлять от 2 до 80 атомов углерода, но обычно в природе чаще всего встречаются кислоты с числом углеродных атомов от 12 до 24. Исчерпывающие сведения о биохимических механизмах биосинтеза ЖК, элонгирования и десатурирования приводятся в статье (Leonard AE et al., Prog.Lipid Res. 2004, 43, 36).
Природные ЖК с одной или несколькими двойными связями могут быть классифицированы в несколько семейств в зависимости от первичного предшественника. Количество семейств по версиям различных Авторов отличаются и доходят до 12 (Gunstone et al., The Lipid Handbook. Chapman and Hall, 1994, 892Р). Однако большинство исследователей считают, что наиболее важные для жизнедеятельности ЖК обьедены в четыре главных семейства (Fischer, Adv.Lipid Res. 1989, 23, 169).
Основные семейства природных полиненасыщенных (метилен-разделенных) жирных кислот.
|
Семейство ПНЖК |
Предшественник |
ЖК входящие в семейства |
|
n-3 семейство |
α-линоленовая кислота (Δ9,12,15-18:3) |
16:3, 16:4,18:4, 18:5, 20:2, 20:3, 20:4, 20:5, 21:5, 22:3, 22:4, 22:5, 22:6, 24:5, 24:6 |
|
n-6 семейство |
Линолевая кислота (Δ9,12-18:2) |
16:2, 18:3, 20:2, 20:3, 20:4, 22:2, 22:3, 22:4, 22:5, 24:4, 24:5 |
|
n-7 семейство |
Пальмитолеиновая кислота (Δ9-16:1) |
16:2, 17:2, 18:3, 19:2 |
|
n-9 семейство |
Олеиновая кислота (Δ9-18:1) |
17:2, 18:2, 20:2, 20:3, 22:3, 22:4 |
Полиненасыщенные жирные кислоты (ПНЖК) из этих семйств условно разделяют на эссенциальные (незаменимые) и не эссенциальные. Эссенциальными для млекопитающих считаются только полиеновые кислоты n-3 и n-6 семейств. Предшественники этих кислот - α-линоленовая кислота (18:3n-3) и линолевая кислота (18:2n-6) не могут синтезироваться в организме млекопитающих, поскольку их биосинтез может осуществляться только в растениях и по пищевым цепям передаваться животным. ПНЖК входящие в соответствующие семейства эссенциальных кислот могут под действием элонгаз и десатураз превращаться в более длинные и ненасыщенные ЖК (Harris, 1996, Curr. Opin. Lipidol., 7, 3). К не эссенциальным ПНЖК относятся кислоты n-7 и n-9 семейств, которые могут образовываться в организме млекопитающих при недостатке в диете эссенциальных ЖК и замещать последние в мембранных липидах (Vergroesen AJ., 1988. Introduction. The Role of Fats in Human Nutrition. Vergroesen and Crawford. 350Р).
Однако в последние годы эта точка зрения на эссенциальность ПНЖК и некоторых других кислот пересматривается в связи с новыми данными по метаболизму ЖК у млекопитающих (Cunnane SC, 2003, Progr. Lipid Res. 42, 544).
Структура и номенклатура ЖК
Среди ЖК по структуре простейшими являются насыщенные. Они не имеют двойных связей и не могут гидрироваться или галогенироваться. При наличии в цепи молекулы ЖК одной двойной связи ЖК называются мононенасыщенными (МНЖК); при двух и более двойных связей называются полиненасыщенными (ПНЖК). Двойные связи в молекуле, как правило, разделяются одной метиленовой группой (метилен-разделенные олефины). Некоторые, необычные ПНЖК содержат две двойных связи разделенные более чем одной метиленой группой (метилен-не–разделенные ЖК). У некоторых животных, главным образом у растений и бактерий, ЖК могут быть более сложными по структуре и иметь или нечетное количество углеродных атомов в молекуле или разветвленные цепи или содержать другие функциональные группы. Это могут быть ацетиленовые связи, эпоксидные, - гидрокси - кето или циклопропановые, циклопентановые, и циклогексановые или -СоА группы. Со всеми, выше перечисленными типами структур ЖК можно ознакомиться ниже по тексту.
Для описания структуры ненасыщенных ЖК используются два подхода.
Химическая номенклатура: Порядок расположения атомов углерода считается с карбоксильной группы с нумерацией атома углерода у начала двойной связи от карбоксила
В качестве примера: 18:2Δ9,12 или цис-9,цис-12-октадекадиеновая кислота, тривиальное название: линолевая кислота. Двойные связи природных ЖК имеют, как правило, Z (цис) конфигурацию, но встречаются ЖК в которых одна или несколько двойных связей имеют E (транс) конфигурацию.
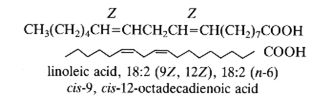
Биохимическая номенклатура: В 1964 году Ральф Хольман (Holman P.T.) предложил новую систему классификации ПНЖК «Омега номенклатуру» для определения метаболически связанных семейств. Номер первой двойной связи считается с метильного конца и отмечаются символом «ω-х» или «n-х», где ω или n – обозначают начало отсчета с метильного конца молекулы ЖК и х - позиция двойной связи или номер атома углерода с метильного конца. Если считать положение первой двойной связи с карбоксильного конца молекулы ЖК, то принято добавлять символ Δ. Таким образом обозначать линолевую кислоту можно как 18:2ω-6; 18:2n-6 или 18:2Δ9,12.
Природные ЖК и их производные
I. Углеродные цепи без заместителей:
1. Насыщенные жирные кислоты
2. Мононенасыщенные жирные кислоты
3. Полиненасыщенные жирные кислоты:
- Метилен-неразделенные жирные кислоты
- Метилен-полинеразделенные жирные кислоты
- Коньюгированные жирные кислоты
- Алленовые ЖК
4. Ацетиленовые жирные кислоты
II. Заместители в углеродных цепях:
- Гидроокси жирные кислоты
- Дикарбоновые кислоты
- Дивинильные простые эфиры жирных кислот
- Серо - содержащие жирные кислоты
- Метокси- и ацетоокси- жирные кислоты
- Амиды жирных кислот
- Кето - жирные кислоты
- Альдегиды жирных кислот
- Галогенированные жирные кислоты
- Азот - содержащие жирные кислоты
- Мышьяк - содержащие жирные кислоты
III. Разветвленные жирные кислоты:
- Моно- мульти- разветвленные жирные кислоты
- Разветвленные гидрокси- жирные кислоты
IV. Жирные кислоты содержащие циклические группы:
- Циклопропановые кислоты
- Циклобутановые кислоты
- Фураноидные кислоты
- Циклогексил- и гексениловые кислоты
- Фенильные и бензойные кислоты
- Эпокси кислоты
- Циклические пероксиды жирных кислот
- Липоевая или тиоктоевая кислота
Далее, в данном обзоре будут рассмотрены ЖК с углеродными цепями без заместителей, их распределение в природных объектах, ссылки на оригинальные работы, а также некоторые физиологические и биохимические эффекты которые они оказывают на живые организмы.
Насыщенные ЖК.
Насыщенные ЖК представляют собой углеродные цепи с числом атомов от 4 до 30 и более и имеют общую формулу: CH3 (CH2)nCOOH. Наименование каждой из них происходит от названия соответствующих углеводородов с прибавлением окончания в англоязычном написании «oic».
Таблица 1. Наиболее распространенные насыщенные жирные кислоты.
|
Систематическое наименование |
Тривиальное наименование |
Сокращенное написание |
Мол. вес |
Точка плавления (°C) |
|
Butanoic бутановая |
Butyric масляная |
4:0 |
88.1 |
-7.9 |
|
Pentanoic пентановая |
Valeric валериановая |
5:0 |
||
|
Hexanoic гексановая |
Caproic капроивая |
6:0 |
116.1 |
-3.4 |
|
Octanoic октановая |
Caprylic каприловая |
8:0 |
144.2 |
16.7 |
|
Nonanoic нонановая |
Pelargonic пеларгоновая |
9:0 |
158.2 |
12.5 |
|
Decanoic декановая |
Capric каприновая |
10:0 |
172.3 |
31.6 |
|
Dodecanoic додекановаЯ |
Lauric лауриновая |
12:0 |
200.3 |
44.2 |
|
Tetradecanoic тетрадекановая |
Myristic миристиновая |
14:0 |
228.4 |
53.9 |
|
Hexadecanoic гексадекановая |
Palmitic пальмитиновая |
16:0 |
256.4 |
63.1 |
|
Heptadecanoic гептадекановая |
margaric маргариновая |
17:0 |
270.4 |
61.3 |
|
Octadecanoic октадекановая |
Stearic стеариновая |
18:0 |
284.4 |
69.6 |
|
Eicosanoic экозановая |
Arachidic арахидиновая |
20:0 |
312.5 |
75.3 |
|
Docosanoic докозановая |
Behenic бегеновая |
22:0 |
340.5 |
79.9 |
|
Tetracosanoic тетракозановая |
Lignoceric лигноцериновая |
24:0 |
368.6 |
84.2 |
Например, С-18:0 называется octadecanoic - октадекановая кислота, но она также имеет тривиальное название, т.е. стеариновая кислота или 18:0.
Растворимость в воде и органических растворителях
ЖК нормального строения более растворимы в воде, чем соответствующие углеводороды, оскольку имеют полярную карбоксильную группу. Короткоцепочечные ЖК с С2 - С6 растворимы в воде и по физиологическому поведению отличаются от других ЖК, поскольку они за счет своей растворимости быстро всасываются в желудочно-кишечном тракте и обладают уникальными свойствами в регулировании траспорта ионов натрия через эпителий слизистой оболочки. Биохимически они более тесно связаны с углеводами, чем с жирами.
Среднецепочечные ЖК С6-12 слабо растворимы в воде и длинноцепочечные ЖК С14 и выше практически не растворимы (Таблица 2)
Таблица 2. Растворимость насыщенных ЖК в воде при 200С (г/литр)
|
К-во атомов углерода |
2 |
4 |
6 |
8 |
10 |
12 |
14 |
16 |
18 |
|
Растворимость |
растворимы |
растворимы |
9.7 |
0.7 |
0.15 |
0.055 |
0.02 |
0.007 |
0.003 |
Важной характеристикой насыщенных ЖК, особенно для технологических процессов, является их растворимость в органических растворителях (Таблица 3)
Таблица 3. Растворимость в органических растворителях при 200С (г/литр).
|
К-во атомов углерода |
Хлороформ |
Бензол |
Циклогексан |
Ацетон |
Этанол 96% |
Уксусная кислота |
Метанол |
Ацетонитрил |
|
10 |
3260 |
3980 |
3420 |
4070 |
4400 |
5670 |
5100 |
660 |
|
12 |
830 |
936 |
680 |
605 |
912 |
818 |
1200 |
76 |
|
14 |
325 |
292 |
215 |
159 |
189 |
102 |
173 |
18 |
|
16 |
151 |
73 |
65 |
53.8 |
49.3 |
21.4 |
37 |
4 |
|
18 |
60 |
24.6 |
24 |
15.4 |
11.3 |
1.2 |
1 |
<1 |
Из Таблицы 3 видно, что нормальные насыщенные ЖК, как правило, более растворимы в хлороформе и бензоле, но слабо растворимы в метаноле и ацетонитриле.
Распределение насыщенных жирных кислот в природе
· Масляная кислота (4:0) первая из семейства ЖК, производных уксусной кислоты, обнаружена в некоторых природных жирах и является обычным компонентом молочных жиров (2 - 4%). Прогорклый запах молочных жиров связан с выделением масляной кислоты при гидролизе триглицеридов. Масляная кислота проявляет ингибирующие свойства для гистон-деацелазной активности и усиливает процессы апоптоза в различных клетках (Urbano A et al., Leukemia 1998, 12, 930). Она была испытана в терапии опухолей и лейкозов (Kasukabe T et al., Br J Cancer 1997, 75, 850). Было также показано, что она является химическим фактором влияющим на развитие стволовых клеток (Liang G et al., J Biol Chem 2010, 285, 25516). Масляная кислота оказывает различные эффекты на клетки, участвующие в воспалительных и иммунных реакциях (Vinolo M et al., Nutrients 2011, 3, 858). Эти ЖК не только подавляют функции лейкоцитов, но также могут вызывать апоптоз в лимфоцитах, макрофагах и нейтрофилах. Имеет очень неприятный запах.
· Капроивая кислота (6:0) найдена в молочных жирах (до 2%). Имеет характерный запах и, поскольку впервые была выделена из молочного жира коз, получила наименование от латинского «caper»- коза. Капроивая кислота в виде эфира с глюкозой обнаружена в трихомах Datura metel.
· Каприловая кислота (8:0) широко представлена в животных и растительных липидах. Особенно много до 70% от общих ЖК в масле семян Cuphea hookerina and C. рainteri (семейство Lythraceae), (Miller RW et al., JAOCS 1964, 41, 279). Содержится в молочных жирах (1-4%) и в кокосовом и пальмовом маслах (6-8%). Каприловая кислота является компонентом активной формы грелина — пептидного гормона, продуцируемого в желудке млекопитающих и обладающего эндокринными функциями, который контролирует энергетический баланс через стимуляцию аппетита (Kojima M et al., Nature 1999, 402, 656).
· Пеларгоновая кислота (9:0) была первой выделенной природной ЖК с нечетным количеством атомов углерода. Найдена в выделениях сальных желез и является обязательным компонентом жира Pelargonium roseum от которой получила свое наименование. Может образовываться как первичный продукт окислительного распада олеиновой кислоты
· Каприновая кислота (10:0) является минорным компонентом жиров. Особенно много ее найдено в спермацете кашалота и в кожных выделения баранов. Является основным компонентом растительных масел (свыше 60%) в Ulmus americana и Zelkova serrata) (Badami RC et al., Prog Lipid Res 1981, 19, 119).
· Лауриновая кислота (12:0) одна из 4 наиболее распространенных насыщенных жирных кислот (14:0, 16:0, and 18:0). Она впервые была найдена в масле из семян Laurus nobilis семейства Lauraceae (Marsson T Ann 1842, 41, 329). Лауриновая кислота доминирует в масле корицы (80-90%), кокосовом масле (40-60%) в виде трилаурина. Лауриновая кислота широко используется в пищевой и химической промышленности, в производстве алкидных смол, мыл и шампуней. В виде моноглицерида используется в фармакологии в качестве антимикробного агента.
· Миристиновая кислота (14:0) особенно много ее в семенах растений семейства Myristicaceae (Myristica fragrans) до 60-70% в виде тримиристина. Много в кокосовом масле также в виде тримиристина, в молочных жирах (8-12%), в спермацете кашалота (15%). Миристиновая кислота в диете человека повышает уровень холестерина в плазме (Mensink RP et al., Arterioscler Thromb 1992, 12, 911).
· Пальмитиновая кислота (16:0) наиболее часто встречающийся компонент среди насыщенных ЖК практически во всех маслах и жирах природного происхождения.
· Стеариновая кислота (18:0) найдена в различных количествах во всех маслах и жирах, включая морские жиры. В молочных жирах ее содержится до 5-15%, свином жире (10%), кокосовом масле 30-35% и является основным компонентом гидрогенезированных жиров (до 90%).
Длинноцепочечные насыщенные ЖК (C20-24) менее распространены в природе и в небольших количествах найдены в маслах из семян растений семейства Leguminoseae и Sapindaceae, (C20-C32) - в пальмовом масле (Puah CW et al., Lipids 2006, 41, 305), (C24-30) - в растительных восках. ЖК (от C24 до C28) найдены в липидах из осадков образованных диатомовыми микроводорослями в концентрациях от 30 до 80% (Volkman JK et al., Org Geochem 1998, 29, 1163).
· Насыщенные высокомолекулярные ЖК более стабильны к воздействию температур и окислению, поскольку не имеют двойных связей и каких либо функциональных групп, кроме карбоксильной. Насыщенные ЖК обнаружены во многих осадках датированных Прекембрием. В этих осадках были найдены ЖК с четным количеством углеродных атомов, но большую часть составляли нечетные ЖК от С8 до С28 (Kvenvolden KA, JAOCS 1967, 44, 628). Экспериментально доказано, что парафины могут быть образованы из нормальных длинноцепочечных ЖК микробиальным декарбоксилированием.
ЖК с разветвленной цепью
Моно- или мульти-разветвленные ЖК
Разветвления в цепи ЖК чаще всего встречаются в углеродном скелете и могут иметь одну или несколько разветвленных метильных групп :
Разветвленные ЖК (моно- разветвленные) могут иметь или метокси- или гидрокси заместители. Они найдены у некоторых животных и в бактериях.
1 – Монометил-разветвленные ЖК в небольших количествах входят в состав липидов растений, животных и микроорганизмов. Животные имеют несколько компонентов этого класса ЖК, которые включают 2- и 4-монометилированные ЖК в железах утки (Kolattukudy PE et al., Arch Biochem Biophys 1991, 284, 201), морской свинки (Yasugi E et al., J Biochem 1991, 110, 202). Изо- антиизо ЖК от С8 до С30 представлены в больших количествах в выделениях сальных желез человека (Nordstrom KM et al., J Invest Dermatol 1986, 86, 700) и в некоторых тканях внутриутробного плода человека (Rissmann R et al., J Invest Dermatol 2006, 126, 1823).
В Ginkgo biloba была найдена 14-метил-16:0 (Hierro MTG et al., J. Am Oil Chem Soc, 1996, 73, 575) до 1% в семенах хвойных семейства Pinaceae (рода Pinus, Abies, Cedrus, Picea) (Wolff RL et al., Lipids 1997, 32, 971). Губки также содержат большие количества разветвленных ЖК от C14 до C30 (Carballeira N et al., Lipids 1989, 24, 229). В липидах морской губки Verongia aerophoba найдена (20-метил-26:0) (Nechev J et al., Eur J Lipid Sci Technol 2002, 104, 800). Необычные монометил ПНЖК (24-метил-5,9-пентакозадиеновая кислота) и (2-метокси-13-метил-6-тетрадеценовая кислота) найдены в различных морских губках (Caballeira NM et al., J Nat Prod 2001, 64, 620). В морской губке Halichondria panicea были описаны структуры 2 новые 2-метил разветвленные моноеновые длинноцепочечные жирные кислоты (2-метил-24:1n-7 и 2-метил-26:1n-9) (Imbs AB et al., Chem Phys Lipids 2004, 129, 173). Надо отметить, что в липидах губок доля разветвленных мононенасыщенных ЖК часто бывает очень высока и регулярно обнаруживаются новые структуры, например 2-метил-13-эйкозаноевая кислота, в губке Leuconia johnstoni (Quevrain E et al., Lipids 2012, 47, 345). Происхождение разветвленных ЖК у губок связывают с бактериями, которые являются обязательным симбиотическим компонентом практически любых губок (Schreiber A et al., Chem Phys Lipids 2006, 143, 29).
Разветвленные изо- антиизо- ЖК широко распространены в бактериях. Их состав и содержание в настоящее время используется для подтверждения систематического положения бактерий. О биосинтезе, функциях и таксономическом значении разветвленных ЖК можно ознакомиться в обзоре (Kaneda T, Microbiol Rev 1991, 55, 288).
Мультиметил-разветвленные ЖК
Мультиметил- разветвленные кислоты распространены главным образом в бактериях. Однако пратически во всех анализируемых пробах на состав ЖК растений и животных можно встретить 2 изопреноидные структуры образованные из хлорофилла. К таким структурам относятся фитановая кислота (3,7,11,15-тетраметил гексаденовая кислота) и пристановая кислота (2,6,10,14-тетраметил пентадекановая кислота), конечный продукт распада хлорофилла. Пристановая кислота была обнаружена во многих природных источниках, в губках, моллюсках, молочных жирах, запасных липидах животных и в нефти. Это соединение является продуктом α-окисления фитановой кислоты. В физиологических концентрациях пристановая кислота является естественным лигандом PPARα (peroxisome proliferator-activated receptor ). В в пероксисомах печени она подвергается β-окислению до пропионил-КоА. Вместе с фитановой кислотой может накапливаться в организме человека при некоторых наследственных заболеванияхй, таких как синдром Зельвегера или синдром Рефсума (Refsum). Более подробно по этой теме можно прочитать в обзоре (Mukherji M et al., Prog Lipid Res 2003, 42, 359-376).
Интересный обзор посвященный ди- , три- и тетраметил- содержащим диеновым, триеновым и гексаеновым жирным кислотам опубликован Дембицким В.М. (Chem Phys Lipids 2003, 123, 117).
Разветвленные метокси ЖК
Изо и антеизо - α-метоксилированные C15-C16 (2-метокси-13-метилтетрадекановая и 2-метокси-14-метилпентадекановая кислоты) были обнаружены в фосфолипидах губки Amphimedon complanata (Carballeira NM et al. Lipids 2001, 36, 83). Авторы показали, что эти кислоты происходили от бактериальных симбионтов губки.
Моноеновые ЖК
Моно-ненасыщенные, нормального строения ЖК широко распространены в живой природе и, главным образом, в виде цис- изомеров. Известо свыше сотни природных моноеновых кислот отвечающих структуре
CH3(CH2)xCH=CH(CH2)yCOOH
Большая часть известных кислот имеет четное количество атомов углерода и одну двойную связь в различных положениях. Двойные связи могут быть в двух стереоизомерных формах: цис (Z) конфигурация или транс (Е) конфигурация.
Цис- моноеновые ЖК
Наиболее распространенной моноеновой ЖК является олеиновая кислота (цис-9-октадеценовая кислота или 18:1n-9) которая присутствует во всех без исключения растительных маслах и животных жирах, правда в незначительных количествах. Наиболее важные моноеновые кислоты приведены в Таблице 5.
|
Систематическое наименование |
Тривиальное наименование |
Короткое написание |
Моль вес |
Точка плавления (°C) |
|
cis-4-decenoic цис-4-деценовая |
Obtusilic обтузиловая |
10:1(n-6) |
170.3 |
|
|
cis-9-decenoic цис-9-десеноевая |
Caproleic капролеиновая |
10:1(n-1) |
170.3 |
|
|
cis-5-dodecenoic цис-5-додеценовая |
5-lauroleic 5-лауроолеиноая |
12:1(n-7) |
198.4 |
|
|
cis-4-dodecenoic цис-4-додеценовая |
Linderic линдериковая |
12:1(n-8) |
198.4 |
|
|
cis-9-tetradecenoic цис-9-тетрадеценовая |
Myristoleic 9-миристоолеиновая |
14:1(n-5) |
226.4 |
- |
|
cis-5-tetradecenoic цис-5-тетрадеценовая |
Physeteric 5-миристоолеиновая |
14:1(n-9) |
226.4 |
|
|
cis-4-tetradecenoic цис-4-тетрадеценовая |
Tsuzuic 4-миристоолеиновая |
14:1(n-10) |
226.4 |
|
|
cis-9-hexadecenoic цис-9-гексадеценовая |
Palmitoleic пальмитоолеиновая |
16:1(n-7) |
254.4 |
0.5 |
|
cis-6-hexadecenoic цис-6-гексадеценовая |
Sapienic сапиеновая |
16:1(n-10) |
254.4 |
|
|
cis-6-octadecenoic цис-6-октадесеновая |
Petroselinic петроселиновая |
18:1(n-12) |
282.4 |
30 |
|
cis-9-octadecenoic цис-9-октадесеновая |
Оleic олеиновая |
18:1(n-9) |
282.4 |
16.2 |
|
tr-9-octadecenoic транс-9-октадесеновая |
Elaidic элаидиновая |
tr18:1(n-9) |
282.4 |
43.7 |
|
cis-11-octadecenoic цис-11-октадесеновая |
Vaccenic вакценовая |
18:1(n-7) |
282.4 |
39 |
|
cis-9-eicosenoic цис-9-эйкозеновая |
Gadoleic гадоленовая |
20:1(n-11) |
310.5 |
25 |
|
cis-11-eicosenoic цис-11-эйкозеновая |
Gondoic гондоеивая |
20:1(n-9) |
310.5 |
- |
|
cis-11-docosenoic цис-11-докозеновая |
Cetoleic цетолеивая |
22:1(n-11) |
338.6 |
|
|
cis-13-docosenoic цис-13-докозеновая |
Erucic эруковая |
22:1(n-9) |
338.6 |
33.4 |
|
cis-15-tetracosenoic цис-15-тетракозеновая |
Nervonic нервоновая |
24:1(n-9) |
366.6 |
39 |
Олеиновая кислота в оливковом масле составляет 60-70% от суммы общих ЖК, но она присутствует в больших количествах и в пальмовом, кокосовом, рапсовом, соевом маслах. В маслах и жирах олеиновая кислота, как и все другие моноены находятся в ацилированном виде в глицеридах, но в некоторых случаях, например у экспериментальных животных потребляющих этанол, моноеновые кислоты могут находиться в виде этиловых эфиров (Hungund BL et al., J Chem Pharmacol 1988, 37, 3001) и содержание этиловых эфиров в крови может служить индикатором алкоголизма. (Laposata M, Prog Lipid Res 1998, 37, 307).
Миристоолеиновая кислота обнаружена в запасных липидах морских и наземных организмов. Она является главным компонентом в масле из семян в семействе Myristicaceae. В некотрых видах содержание 14:1 может достигать 30% и превышать содержание 14:0. Изомеры миристоолеиновой кислоты найдены в жирах морских млекопитающих (TsujimotoM, Chem Umschau 1925, 32, 202) и, главным из них был изомер 5-тетрадеценовой кислоты. Более редкие изомеры были описаны в липидах сетчатки глаз. Кроме того, было показано, что в плазме крови этот изомер может иметь диагностическое значение для пациентов с дефектами окисления длинноцепочечных ЖК (Onkenhout W et al., Clin Chem 1995, 41, 1467).
Пальмитолеиновая кислота (16:1(n-7) распространена главным образом в животных жирах, особенно ее много в морских липидах. В растениях найдена в семенах Asclepis syriaca семействаAsclepediaceae (до 10%) (Chisholm MJ et al., Can J Chem 1960, 38, 2500), в семенах Macademia ternifolia (до 20%) (Bridge RE et al., J Chem Soc 1950, 2396) и в Roureopsis obliquifoliata семейства Connaraceae (до 32%) (Spencer GF et al., JAOCS 1978, 55, 689). Пальмитоолеиновой кислоты много (до 22%) в облепиховом масле Hippophae rhamnoides. Потенциальные потребности в 16:1n-7 могут составить до 1.5млн. тонн в год, поскольку один из продуктов ее переработки 1-октен используется как пластификатор при получении линейного полиетилена низкой плотности. Методами генной инженерии были активированы биосинтетические механизмы синтеза 16:1n-7 в (Arabidopsis thaliana) (Nguyen HT et al., Plant Physiol 2010, 154, 1897), что позволяет рассматривать это растение как перспективное для ее промышленного использования. Пальмитолеиновая кислота в жировой ткани активирует гормон липидного обмена липокин (lipokine), который стимулирует действие инсулина у мышей и подавляет стеатогепатит или жировую дистрофию печени (Cao H et al., Cell 2008, 134, 933). Содержание пальмитолеиновой кислоты в сыворотке крови в составе эфиров холестерина влияет на синтез ЖК из углеводов в печени (Lands W et al., Am J Clin Nutr 1995, 61, 721). Кроме того, как продукт эндогенного синтеза в печени, содержание пальмитолеиновой кислоты коррелирует с индексами ожирения и концентрацией инсулина (Kunesova M et al., Lipids 2002, 37, 27).
Петроселиновая кислота - 18:1(n-12) представлена как главный компонент (от 15 до 60%) у некоторых видов растений семейства Umbelliferae (кориандр) и у аралиевых (Hedera helix). Масла семян рода Thapsia (Umbelliferae) использовались как источник для промышленного получения 18:1(n-12), которая применяется в пищевой, косметической, химической и фармацевтической промышленности (Avato P et al., Lipids 2001, 36, 845).
Вакценовая кислота - 18:1(n-7) названа от латинского Vacca - корова, поскольку впервые была выделена из молочного жира (Bertram SH, Biochem Z 1928, 197, 433).
Гадолевая кислота - 20:1(n-11) была впервые выделена их жира трески и всегда встречается в рыбных жирах. Более короткоцепочечный предшественник семейства n-11 гадолевой кислоты 16:1n-11 обязательный компонент липидов психрофильных бактерий рода Bacillus (Kaneda T, Biochem Biophys Res Commun 1971, 43, 298) и термофильных бактерий рода Chthonomonas (Vyssotski M et al., Lipids 2011, 46, 1155).
Эруковая кислота - 22:1(n-9), обнаружена в количества до 50% в семенах растений семейства Cruciferae и Tropaeolaceae (38-48%). Эруковая кислота растительного происхождения используется в химической промышленности, например в качестве пластификатора в производстве полиэтиленовых пленок.
Нервоновая кислота - 24:1(n-9), впервы была выделена из липидов рыб (Tsujimoto M, J Soc Chem Ind Japon 1927, 30, 868), затем из цереброзидов мозга. Используется вместе с эруковой кислотой в производстве высокотемпературных смазок и в производстве нейлона.
Транс моноеновые кислоты
Описаны один геометрический и несколько позиционных изомеров олеиновой кислоты с транс двойной связью. Среди природных транс- изомеров двойная связь встречается в (n-13), (n-12), (n-9) или (n-7) положении.
У раститений практически не встречаются транс- изомеры, если эти масла не подвергались высотемпературной обработке. Однако в животных жирах и жиросодержащих продуктах животного происхождения транс- кислоты встречаются очень часто, например в молоке и молочных продуктах.
К наиболее распространенным транс моноеновым кислотам надо отнести элаидиновую кислоту (транс-9-октадеценовая) и транс-вакценовую кислоту (транс-11-октадеценовая) которые найдены в молочных продуктах и в запасных липидах жвачных животных. Транс-вакценовая кислота является основным транс- изомером этой ЖК в некоторых продуктах питания (молоко, иогурт, сыры, животные масла и мясо) и образуется через процесс биогидрогенизации руменовой кислоты микрофлорой в рубце жвачных животных.
Необычная транс - гексадеценовая (транс-3-гексадеценовая кислота транс-16:1n-13) присутствует в фосфатидилглицерине фотосинтетических мембран высших растений и зеленых водорослей (Gounaris K et al., Biochem J 1986, 237, 313).
Транс ЖК могут формироваться некоторыми бактериями (главным образом грамм положительными при анаэробных условиях), через миграцию и изомеризацию двойной связи.
Транс изомеры составляют около 4,5% от общего количества ЖК в молочном жире овцы и до 3% в жире козьего молока. В Греции овечье и козье молоко и продукты из них обеспечивает около 45% ежедневного потребления вакценовой кислоты. Ежедневное потребление на душу населения транс-18:1 кислот из жиров жвачных животных, по оценкам, составляет около 1,5 г для населения большинства стран ЕЭС (Wolff RL, AOCS 1995, 72, 259). С биологическими эффектами индивидуальных изомеров транс ЖК можно ознакомиться в обзоре (Gebauer SK et al., Lipids 2007, 42, 787). Более полную информацию о транс кислотах можно найти на сайте: Trans fat Infoweb Page
Фураноидные жирные кислоты
Эти кислоты содержат в углеводородной цепи фурановое кольцо. Они впервые были выделены из масла семян Exocarpus cupressiformis (Santalaceae) (Morris LJ et al., Tetrahedron Lett 1966, 36, 4249). Они обнаружены в липидах рыб, моллюсков, мягких кораллах, млекопитающих, включая человека (Glass RL et al., Lipids 1977, 12, 828; Puchta V et al., Liebigs Ann Chem 1988, 25). У человека фурановые кислоты локализованы главным образом в фосфолипидах. Фурановые кислоты найдены в клетках некоторых морских бактерий и полагают, что они по пищевым цепям передаются организмам более высокого уровня (Shirasaka N et al., Biochim Biophys Acta 1995, 1258, 225). Недавно были выделены 3 новых производных фурановых кислот из морской губки Plakortis simplex. Эти кислоты обладали высокой цитотоксичностью (Shen YC et al., J Nat Prod 2001, 64, 324). Фурановые кислоты найдены в липидах 10 родов горгониевых кораллов не имеющих зооксантелл. Однако у корараллов с зооксантеллами фурановые кислоты отсутствовали (Imbs AB et al., Chem Nat Compounds 2009, 45, 898). Фурановые кислоты проявляют антиоксидантные свойства, связывая свободные радикалы (Оkada Y et al., Biol Pharm Bull 1996, 19, 1607). В первых in vivo экспериментах на моделях с адьювант-индуцированным артритом с использованием фурановых кислот выделенных из моллюска Perna canaliculus было показано, что они обладают более высоким антивоспалительным потенциалом, чем эйкозапентаеновая кислота (ЭПК) (Wakimoto T. et al., PNAS 2011, 108, 17533). С разнообразными свойствами природных фурановых кислот можно ознакомиться в обзоре (Spiteller G, Lipids 2005, 40, 755).
Эпокси кислоты
Эпокси кислоты представлены в большом количестве, главным образом в триглицеридах во многих маслах из семян и в липидах кутикулярного слоя растений. В природе чаще всего встречаются насыщенные и ненасыщенные С-18 компоненты. При хранении они могут переходить в гидроокси производные. Например, 9,10-эпоксистеариновая и 9,10-эпоксиоктадекан-12-еноивая (коронариевая сoronaric) кислоты обнаруживают подсолнечном масле (Chrysanthemum). Масло из семян Bernardia pulchella (Euphorbiaceae) содержит до 91% коронариевой кислоты (Spitzer V et al., JAOCS, 1996, 73, 1733). Эти кислоты испльзуются в производстве специальных красок. В липидах кутикулярного слоя эти две эпокси кислоты могут составлять до 31% от суммы ЖК. В семенах видов из семейств Vernoniaи Stokesia эпокси кислоты являются основными ЖК. Вернолевая кислота, изомер коронариевой кислоты, охарактеризована как 12,13-эпокси-9-октадеценовая кислота (Gunstone FD, J Chem Soc 1954, 1611). Небольшие количества вернолевой и коронариевой кислот были обнаружены в маслах из проростков арахиса (Arachis hypogaea) (Hammond EG et al., JAOCS, 1997, 74, 1235) и в семенах герани Geranium sanguineum (Geraniaceae) (Tsevegsuren N et al. Lipids 2004, 39, 571).
С-20 гомологи вернолевой кислоты цис-14,15-эпокси-цис-11-эйкозеновая кислота (алхорниевая, alchornic) была найдена в масле из семян Alchornea cordifolia (Euphorbiaceae) (Kleiman R et al., Lipids 1977, 12, 610). Эпокси кислоты часто находят в бактериальных липидах. Эпоксиды могут образовываться в процессе пероксидных атак на ненасыщенные ЖК. Эпоксиды можно синтезировать при обработке растительных масел (главныи образом ненасыщенных кислот) с пероксимуравьиной кислотой, которые используются для стабилизации полиуретана и в специальных сортах резины и мыл (Kong X et al., Lipid Technol 2012, 24, 7).
В живых организмах коронариева и вернолиевая кислоты, известны как лейкотоксины, которые образуются в легких, сосудистой системе и нейтрофилах под действием цитохрома P450 (эпоксидазы) и участвуют в регуляции сосудистого тона, гомеостаза, в регуляции давления крови. Показно, что эпокси кислоты проявляют токсические эффекты на сердечнососудистую систему (Slim R et al., Toxicol Appl Pharmacol 2001, 171, 184). Лейкотоксины являются токсическими медиаторами, например ожоговые токсины, вызывая синдром нарушения дыхания у ожоговых пациентов (Hayakawa M et al., Biochem Int 1990, 21, 573). Гидратированные производные – лейкотоксин-диолы еще более токсичны, чем лейотоксины in vitro (Moghaddam MF et al., Nature Med, 1997, 3, 562) и in vivo (Zheng J et al., Am J Respir Cell Mol Biol 2001, 25, 434). Эпоксиды ПНЖК, также образующиеся под действием цитохрома P450, являются биологически активными соединениями с очень высоким потенциалом. Гидроокси - производные арахидоновой кислоты (АА), продукты действия липиксигеназы – гепоксилины (hepoxilins) являются важным элементом каскада АА в живых организмах.
Эндопероксиды циклических жирных кислот
Известно, что циклические пероксиды могут образовываться при автоокислении ПНЖК. Впервые эти соединения были найдены в общих липидах выделенных из губки Plakortis halicondrioides (Higgs M D et al., J Org Chem 1978, 43, 3454). Поэтому соединения этого ряда получили название плакиновые (plakinic) кислоты (Davidson, B. S. J. Org. Chem., 1991, 56, 6722) и они обладают сильными противогрибковыми свойствами (Kobayashi M et al., Pharm Bull, 1993, 41, 1324). Кроме того показано, что производные плакиновых кислот – плакортоны А-Д являются активаторами сердечной Ca-зависимой ATPазы (Patti AD et al., Tetrahedron 1996, 52, 377). Некоторые гомологи циклических пероксидов выделенные из морских губок проявляют выраженную противораковую активность (Harrison B et al., J Nat Prod 1998, 61, 1033) и ингибируют развитие лейшманиоза (Compagnone RS et al., Tetrahedron 1998, 54, 3057).
Липоевая кислота
Это вещество впервые было идентифицировано в микроорганизмах и рассматривалось как фактор роста микроорганирзмов. Липоева кислота обнаружена во многих дрожжах и в говяжьей печени, из которой он впервые был выделено в чистом виде (Reed LJ et al., J Am Chem Soc 1953, 75, 1267). Это выделение является одним из наиболее впечатляющих достижений в области очистки природных соединений. Для выделения 30 мг кристаллической липоевой кислоты было переработано 10 тонн говяжей печени. Синонимы липоевой кислоты являются тиоктовая или 1,2-дитиолан-3-пентановая кислота. В организме человека большая часть липоевой кислоты ковалентно связана с молекулами лизина. Липоевая кислота является эффективным антиоксидантом, поскольку представляет собой окислительно-восстановительных пару, модулируя соотношение NADH/NAD, тем самым проявляя фармакологический эффект (Packer L et al., Free Radic Biol Med 1997, 22, 359). Связывая гидрокси- и перокси- радикалы и, тем самым, хелатирует молекулы переходных металлов (Fe, Cu). Считается, что липоевая кислота один из самых мощных природных антиоксидантов, эффективна при многих сердечнососудистых заболеваниях и в настоящее время используется для снятия осложнений при диабете (Packer L et al. The antioxidant miracle. John Wiley & Sons 1999).
Ацетиленовые жирные кислоты
Этот класс природных соединений содержит в углеродном скелете одну или несколько тройных связей в дополнение к одной или нескольким двойным связям. Химический синтез позволяет получить разнообразные ацетиленовые кислоты, но только некоторые из них найдены в природных маслах и жирах.
Моноацетиленовые кислоты
Впервые ацетиленовые кислоты (тарировая кислота) была открыты в семенах Picramnia Sow (Simarubaceae) еще в 19 веке (Arnaud A, C R Acad Sci 1892, 114, 79). Тропические растения семейств Santalaceae и Olacaceae содержат в своих липидах от 50 до 90% ацетиленовых кислот. Наиболее распространены среди растительных ацетиленовых кислот стеаролиновая (stearolic) или 9-октадециновая кислота.
Таурировая (tariric) или 6-oктадециновая кислота была впервые выделена из семян Picramnia tariri (Simarubiaceae) (Arnaud A, C R Acad Sci 1892, 114, 79). Позднее было показано, что в Picramnia sow ее содержание достигает 95% (Steger A et al., Rec Trav Chim 1933, 52, 593). Из растительных масел выделена санталбициновая (santalbic или хimenynic) кислота(Gunstone FD et al., Chem Ind 1954, 1112). Из бихимических свойств наиболее значимым является спосбность ацетиленовых кислот (в том числе и полученной химическим синтезом АА с тройной связью в Δ5 положении углеродной цепи) ингибировать липоксигеназы и простагландин синтетазы в каскаде АА (Liu Y et al., Lipids 1997, 32, 965).
Две ацетиленовые кислоты (6-октадециновая и 6-нонадециновая) были выделены из корней Pentagonia gigantifoliа (Rubiaceae) и проявляли высокую противогрибковую активность на штаммах Candida albicans (Li XC et al., J Nat Prod 2003, 66, 1132). Их антигрибковый потенциал был сравним с активностью амфотерецина B и флюконазола, но при этом эти кислоты имели низкий уровень цитотоксичности.
6,9-октадецеиновая кислота (6-oктадецен-9-иновая) была выделена из орехового масла Ongokea klaineana. Это соединение содержало одну двойную связь в 6 положении и тройную связь в 9 положении углеродного скелета.
Крепениновая кислота (9-октадецен-12-иновая) обнаружена (до 60%) масле из семян Crepis foetida (Compositae) (Mikolajczak KL et al., J Org Chem 1964, 29, 318). Токсический эффект этого вида растения обьясняется присутствием именно крепениновой кислоты.
Склеропирициновая кислота выделенная из Scleropyrum wallichianum (Suksamrarn A et al., Chem Pharm Bull 2005, 53, 1327) обладала высокой антимикробиальной (MIC : 25 мкг/мл) и антиплазмоидальной (MIC : 7.2 мкг/мл) активностями.
Полиацетиленовые жирные кислоты
Полиацетиленовые ЖК обычно не встречаются в живых организмах и их находят в некоторых актиномицетах. Микомицин - тридекатетра-3,5,7,8-тетра-10,12-дииновая кислота выделенная из актиномицетов ингибировала активность микобактерий обнаруженных в выделениях больных туберкулезом (Johnson EA et al J Bacteriol 1947, 54, 281). Эта ЖК имеет две тройных связи и алленовую структуру: Три ЖК с алленил-дииновой структурой – фомалиновые кислоты А-С (phomallenic acids A-C) были выделены из ферментного бульона Phoma sp. Фомаленовая кислота С специфически ингибировала бактериальный путь FAS II биосинтеза ЖК (Ondeyka JG et al., J Nat prod 2006, 69, 377).
Исчерпывающий обзор по биохимии и молекулярной генетике растительных полиацетиленовых кислот был недавно опубликован: Minto RE et al. (Prog Lipid Res 2008, 47, 233).
Полиеновые жирные кислоты
Полиненасыщенными ЖК принято называть кислоты, имеющие две и более двойных связей и которые разделены между собой простой метиленовой группой (метилен-разделенные полиены; methylene-interrupted polyenes). Линолевая кислота 18:2n-6 является типичным представителем этой группы кислот. Некоторые полиеновые кислоты могут иметь одну транс- двойную связь. В некоторых случаях двойные связи в поленовых кислотах могут мигрировать с образованием коньюгированных ЖК (conjugated fatty acids).
-C-C=C-C=C-C-
Коньюгированная двойная связь
Известны кислоты, которые не обладают регулярной структурой расположения двойных связей, которые не разделены метиленовыми группами (non-methylene-interrupted). Они встречаются в некоторых классах бактерий, растениях, морских беспозвоночных и насекомых.
-C=C-C-C-C-C=C-
полиметилен разделенные двойные связи
ПНЖК имеющие алленовые двойные связи (allenic double bonds) или кумуленовые двойные связи (cumulenic double bonds), т.е. две или три расположенные рядом двойные связи. Они обнаружены в некоторых высших растениях.
-C=C=C-
алленовые двойные связи
-HC=C=C=CH-
кумуленовые двойные связи
Метилен-разделенные полиены
Большинство наиболее важных для жизнедеятельности любых организмов ПНЖК относятся по структуре к двум классам (n-6) серии и (n-3) серии (Таблица 6). Структурно они идентичны, за исключением расположения первой двойной связи с метильного конца молекулы. Ниже приводится пример структуры ПНЖК n-3 семества имеющей двойные связи в 5, 8, 11, 14, и 17 положении (20:5n-3; эйкозапентаеновая кислота, тимнодоновая кислота).
Таблица 6. Наиболее важные ПНЖК n-6 и n-3 семейств
|
Систематическое наименование |
Тривиальное наименование |
Короткое написание |
Моль вес |
Точка плавления (°C) |
|
Δ9,12-octadecadienoic Δ9,12-октадекадиеновая |
Linoleic линолевая |
18:2(n-6) |
280.4 |
-5 |
|
Δ 6,9,12-octadecatrienoic Δ 6,9,12 октадекатриеновая |
α-linolenic α-линоленовая |
18:3(n-6) |
278.4 |
|
|
Δ 8,11,14-eicosatrienoic Δ 8,11,14-эйкозатриеновая |
dihomo-γ-linolenic дигомо-γ-линоленовая |
20:3(n-6) |
306.5 |
|
|
Δ 5,8,11,14-eicosatetraenoic Δ5,8,11,14-эйкозатетраеновая |
Arachidonic арахидоновая |
20:4(n-6) |
304.5 |
-50 |
|
Δ 7,10,13,16-docosatetraenoic Δ7,10,13,16-докозатетраеновая |
adrenic адреновая- |
22:4(n-6) |
332.6 |
|
|
Δ 4,7,10,13,16-docosapentaenoic Δ4,7,10,13,16-докозапентаеновая |
- |
22:5(n-6) |
330.6 |
|
|
Δ 9,12,15-octadecatrienoic Δ9,12,15-октадекатриеновая |
α-linolenic α-линоленовая |
18:3(n-3) |
278.4 |
-11 |
|
Δ 6,9,12,15-octadecatetraenoic Δ6,9,12,15-октадекатетраеновая |
Stearidonic стеаридоновая |
18:4(n-3) |
276.4 |
-57 |
|
Δ 8,11,14,17-eicosatetraenoic Δ8,11,14,17-эйкозатетраеновая |
- |
20:4(n-3) |
304.5 |
|
|
Δ 5,8,11,14,17-eicosapentaenoic Δ5,8,11,14,17-эйкозапентаеновая |
EPA эйкопентаеновая, тимнодоновая |
20:5(n-3) |
302.5 |
-54 |
|
Δ 7,10,13,16,19-docosapentaenoic 7,10,13,16,19-докозапентаеновая |
DPA клупанодоновая |
22:5(n-3) |
330.6 |
|
|
Δ 4,7,10,13,16,19-docosahexaenoic Δ4,7,10,13,16,19-докозагексаеновая |
DHA докозагексаеновая |
22:6(n-3) |
328.6 |
-44 |
|
Δ 6,9,12,15,18,21-tetracosenoic Δ6,9,12,15,18,21-тетракозеновая |
Nisinic низиновая |
24:6(n-3) |
356.6 |
n-6 полиненасыщенные жирные кислоты
Линолевая кислота (18:2n-6) - наиболее часто встречаемая ПНЖК у растений и животных. Основные источники соевое, подсолнечное, хлопковое масла. Линолевая кислота не может синтезироваться животными и должна поступать организм с диетой. Поэтому линолевая кислота является незаменимой ЖК для животных и является предшественником всех ПНЖК (n-6) серии. В растительных маслах было обнаружено два транс изомера цис-9,транс-12 и транс-9,транс-2t изомеры. Особенно богаты линолевой кислотой липиды насекомые, у которых ее содержание может составлять 0.45-2.7г/100г общего веса насекомых или 9-21% от общих ЖК (Yang LF et al., J Food Lipids 2006, 13, 277-285).
γ-линоленовая кислота (18:3n-6) является первым промежуточным продуктом в биосинтезе ПНЖК n-6 серии. Эта кислота часто является основной в некоторых растительных маслах. Информацию о распространении, свойствах и методах выделения из растительных источниковможно найти в обзорах(Clough PM, Structured and modified lipids, Gunstone FD Ed, M Dekker, NY 2001, pp.75-117; Guil-Guerrero JL et al., JAOCS 2001, 78, 677). Имеются сведения о разработке генетически модифицированного рапса с повышенным содержанием 18:3n-6 (Lassner M, Lipid Technol 1997, 9, 5). Некоторые виды микроорганизмов родов Mucor и Mortierella являются потенциальными источниками 18:3 n-6 (8-18%) (Ratledge C, Structured and modified lipids, Gunstone FD Ed, M Dekker, NY 2001, p. 351).
Дигомо-γ-линоленовая кислота (20:3n-6) – Эта кислота в незначительных количествах (до 5%) была найдена в грибах рода Mortierella и Condiobolus. Более высокий (до 18%) уровень этой кислоты может быть получен при ферментативной обработке 18:3n-6 с гомогенатом из грибов рода Mortierella (Ratledge C, Structured and modified lipids, Gunstone FD Ed, M Dekker, NY 2001, p. 351).
Арахидоновая кислота (20:4n-6) – является наиболее важной из кислот этой серии, поскольку входит в состав фосфолипиды клеточных мембран и является предшественником гормоно-подобных соединений известных как эйкозаноиды (простаноиды, изопростаны и изофураны). Эта кислота редко встречается в наземных растительных организмах и найдена в некоторых простейших грибах, слизях (Structured and modified lipids, Gunstone FD Ed, M Dekker, NY 2001, p. 351; Gellerman JL et al., Biochim Biophys Acta 1975, 388, 277) микроводорослях, в бурых, красных и зеленых морских водорослях (Bigogno C et al. Phytochemistry 2002, 60, 497). Образование AA трансгенными растениями подробно излагается в обзоре (Domergue F et al. Trends Plant Sci 2005, 10, 113). Было описано уникальное семейство изомерных производных AA образующихся с участием NO2 (Jiang H et al., J Biol Chem 1999, 274, 16235). Количественное определение транс-AA in vivo может использоваться в качестве особого индекса при оценке степени угнетения клеточной активности вызванной NO2 (Zghibeh CM et al., Anal Biochem 2004, 332, 137).
Докозапентаеновая кислота (22:5n-6)в следовых количествах обнаруживается во многих тканях наземных млекопитающих, но в больших количествах эту кислоту идентифицировали в тестисе крыс, что позволило сделать вывод об участии этой кислоты в работе репродуктивных органов (Kirschman JC et al., Arch Biochem Biophys 1961, 93, 297). Позже, в липидах репродуктивных органов крыс были найдены 24:4n-6 и 24:5n-6 (Bridges RB et al., J Biol Chem 1970, 245, 46).
ПНЖК n-6 серии с длиной углеродной цепи от 26 до 38 были обнаружены в повышенных концетрациях в мозгу пациентов с редким наследственным заболеванием, синдромом Зеллвегера (Sharp P et al., Biochem J 1987, 248, 61). Сверх длинноцепочечная ЖК 34:9n-6 была идентифицирована в липидах пресноводного моллюска Bathynella natans (Rezanka T et al., Tetrahedron 2004, 60, 4261). 28:7 n-6 и другие сверх длинноцепочечные ПНЖК были найдены в рыбных жирах (Rezanka T, J Chromatogr 1990, 513, 344) и их происхождение связывают с питанием, поскольку в некоторых динфлягеллятах идентифицирована 28:7n-6 (Mansour MP et al., Phytochemistry 1999, 50, 541; Rezanka T et al., Phytochemistry 2008, 69, 2391).
n-3 полиненасыщенные жирные кислоты
α-линоленовая кислота (18:3n-3) Главный компонент в липидах фотосинтетического аппарата растений и является предшественником ПНЖК n-3 серии. Основными пищевыми источниками этой кислоты для человека являются соевое, рапсовое и льняное масла.
Стеаридоновая кислота (18:4 n-3) образуется десатурированием in vivo 18:3n-3и является предшественником ЭПК. Она обнаружена в рыбных жирах, но может присутствовать в некоторых растительных липидах, например в Boraginaceae (листья и семена) до 4-19% (Rincon-Cervera MA et al., Eur J Lipid Sci Technol 2010, 112, 227). Обзор, посвященный данной кислоте опубликован ранее (Clough PM, Structured and modified lipids, Gunstone FD Ed, M Dekker, NY 2001, pp.75-117). Стеаридоновая кислота продуцируется некоторыми микроорганизмами (Mortierella alpine) в минорных количествах, но в составе фосфатидилхолина ее концентрация может достигать 8% (Jareonkitmongkol S et al., Appl Environ Microbiol 1992, 58, 2196). В семена Agathis robusta (Araucariaceae) были найдены небольшие количества ЭПК, вероятно образованной из стеаридоновой кислоты (Wolff RL et al. Lipids 1999, 34, 1083). С обзором о стеридоновой кислоте, как потенциальной альтернативе морским ПНЖК (ЭПК и ДГК) можно ознакомиться (Coupland K, Lipid Technol 2008, 20, 152). Обзор о фармакологическом потенциале представлен Whelan J (J Nutr 2009, 139, 5).
Эйкозапентаеновая кислота (20:5 n-3) и/или ДГК (22:6 n-3) широко распределены в морских микро- и макрофитах, которые являются первичными источниками в пищевых цепях и в липидах многих тканей (главным образом в нервных тканях) животных. Ряд исследований показали, что ДГК выполняет важнейшие функции в мозге и в органах зрения (Mitchell DC et al. Biochem Soc Trans 1998, 26, 365). Считается, что ДГК может синтезироваться в организме животных из 18:3n-3. Однако последняя стадия десатурирования ферментом (Δ4-десатураза) была обнаружена только в микроводорослях (Pereira SL et al., Biochem J 2004, 384, 357). У прокариотов найден другой путь биосинтеза ДГК, который проходит в анаэробных условиях – поликетидный путь. Недавно показано, что поликетидный путь биосинтеза ДГК помимо микроорганизмов и бактерий (Wada M et al., J Bacteriol 1989, 171, 4267) реализуется и у некоторых эукариотов, например у Schizochytrium sp. (Thraustochytriidae) (Metz JG et al., Science 2001, 293, 290).
У млекопитающих 22:5n-3 элонгируется до 24:5n-3 с последующим десатурированием Δ6-десатуразой до 24:6n-3. Эта кислота переносится в пероксисомы и конвертируется до ДГК через процесс β-окисления (Sprecher H, Biochim Biophys Acta 2000, 1486, 219). Дефицит этой ферментативной стадии отмечен у пациентов с синдромом Зейлвегера (Zellweger), связанного с дефицитом ДГК во всех тканях, включая мозг и сетчатку глаз (Martinez M, Brain Res 1992, 583, 171). Астроциты печени и мозга считаются основными центрами биосинтеза ДГК и по индексу ω-3 можно оценить ω-3 статус животного. Этот индекс определяется как сумма ЭПК и ДГК в виде молярной доли от общей суммы ЖК в мембранах эритроцитов (Harris WS et al., Prev С 2004, 39, 212).
ЭПК и ДГК являются важными компонентами триглицеридов рыбных жиров и их положительное влияние на здоровье разнообразно и направлено против многих заболеваний человека (см. сайт "Fats of Life"). Жиры наиболее распространенных морских рыб, содержат относительно высокие концентрации n-3 ПНЖК и имеют, как правило, низкое соотношение n 6/n-3, что ставит их в ряд особо ценных природных продуктов для здорового питания (Weaver KL et al., J Am Diet Assoc 2008, 108, 1178). Несмотря на то, что положительное влияние ДГК наблюдается при многих системных заболеваниях, остается не вполне ясными биохимические механизмы этого влияния. Один из возможных механизмов может заключаться в регуляторной роли гидроксилированных производных ДГК - резольвинов, F4 изопростанов и F4 изофуранов (Siddiqui RA et al., Chem Phys Lipids 2008, 153, 47). Отмечено, что развитие головного мозга и зрительной системы при внутриутробном развитии человека зависит от источников ДГК в питании матери (Crawford MA et al., OCL 2004, 11, 30). Было показано, что ДГК непосредственно вовлечено в формирование нейронов и элементов зрительной системы через синтез фосфатидилсерина и регуляцию сигнальной системы клеток (Akbar M et al., PNAS 2005, 102, 10858). Показаны многочисленные эффекты ДГК на фоторецепторы глаз (защита через ингибирование апоптоза, экспрессию опсина). Помимо структурной роли, ДГК является, одним из важнейших трофических факторов, необходимых для этих клеток (Politi L et al., Lipids 2001, 36, 927). Исследования с использованием Δ-6 десатуразы генно модифицированных мышей показали, что добавление ДГК с пищей восстанавливает сперматогенез и увеличивает рождаемость в отсутствие 22:5n-6 и низких количествах АА в семенниках, в то время как добавление с пищей АА оказывало гораздо меньший эффект. (Roqueta-Rivera M et al., J Lipid Res 2010, 51, 360). Кроме того, несмотря на достаточное количество линолевой кислоты и γ-линоленовой кислоты в рационе питания мышей, но в отсутствии ДГК у них развивались язвы кишечника и острые дерматиты. Многочисленные исследования показали, что имеется прямая зависимость между потреблением n-3 ПНЖК и онкологическими заболеваниями (MacLean CH et al., JAMA 2006, 295, 403).
Медицинские аспекты действия n-3 ПНЖК
Предполагаемые механизмы, посредством которых морские n-3 ПНЖК могут влиять на процессы канцерогенеза подробно изложены в обзоре Ларсона и сотр. (Larsson SC et al., Am J Clin Nutr 2004, 79, 935). Влияние n-3 ПНЖК на сердечно-сосудистые заболевания рассмотрены Массаро и сотр. (Massaro M et al., Prost Leukotr Essent Fatty Acids 2008, 79, 109). Интересен обзор литературы об эффектах n-3 ЖК на когнитивные функции у пожилых людей (Issa AM et al., Dement Geriatr Cogn Disord 2006, 21, 88). Авторы пришли к выводу, что имеющиеся данные (497 исследований) недостаточны, чтобы сделать обоснованные выводы о воздействии n-3 ПНЖК на когнитивные функции при нормальном старении или при лечении деменции. Однако, в более позднем исследовании пришли к выводу, что у питающихся рыбой пациентов (210 человек в возрасте 70-89) потребляющих от 20 до 400 мг ЭПК + ДГК в день не менее 5 лет не наблюдали когнитивного упадка, по сравнению с не употребляющими рыбу пожилыми людьми (Van Gelder BM et al., Am J Clin Nutr 2007, 85, 1142). Взаимосвязь между ДГК и его метаболитами (нейропротектинами) и участие ДГК в патогенных процессах, характерных для старения и нейродегенеративных заболеваний были существенно пересмотрены в последние годы (Lukiw WJ et al., J Nutr 2008, 138, 2510). Об актуальности данной проблемы можно судить о выходе ежеквартально новостей о всех аспектах n-3 ЖК на сайте PUFA Newsletter.
ЭПК идентифицирована как значимый компонент в липидах некоторых грибов и водорослей, но как правило, в коммерческих целях эти источники не используются. Исключение составляют некоторые виды культивируемых микроводорослей(Owen PW et al., Proc Biochem 2005, 40, 3627). Уровень ЭПК и ДГК в бактериях не высок и, как в грибах, эти ЖК накапливаются в бактериальных мембранах. В простейшей плесени Mortierella до 15 % ЭПК может находиться в триглицеридах, которые составляют до 40% от сухого веса. Более подробно о распространении ЭПК и ДГК в микроорганизмах (грибы, слизи, микроводоросли) можно ознакомиться в обзорах Ratledge C (Structured and modified lipids, Gunstone FD Ed, M Dekker, NY 2001, p.351), Russell NJ et al. (Microbiology 1999, 145, 767) и Harwood JL et al. (Biochimie 2009, 91, 679). Компания «Martek» получает ДГК из одноклеточной гетеротрофной микроводоросли Crypthecodinium cohnii содержащей ее до 40% и добавляет кислоту во многие пищевые продукты, например в детское молоко (Kyle DJ, Lipid Technol News 1997, 3, 100).
Биосинтез ЭПК и ДГК трансгенными растениями, которые могут заменить традиционные источники в питании человека и животных освещен в обзоре Domergue F et al. (Trends Plant Sci 2005, 10, 113). Обзор показывающий проблемы при продуцировании n-3 длинно цепочечных ПНЖК трансгенными растениями представлен Напиером Ж.А. (Napier JA, Eur J Lipid Sci Technol 2006, 108, 965). Среди различных стратегий, которые реализуются при получении n-3 ПНЖК из растений, одна является наиболее многообещающей – использование трансгенных растений «reverse-engineered» для получения так называемых «растительных рыбных жиров» (Venegas-Caleron M et al., Prog Lipid Res 2010, 49, 108) и (Sayanova O et al., Prost Leukotr Essent Fatty acids 2011, 85, 253). Информацию о различных традиционных природных источниках n-3 ПНЖК можно найти в обзоре (Nichols PD et al., Nutrients 2010, 2, 572). Подробно о мембранных свойствах ДГК можно познакомиться в обзоре (Stillwell W et al., Chem Phys Lipids 2003, 126, 1).
ЭПК содержится в галактозил диглицеридах и фофсолипидах морских диатомовых которые, как было показано, являются источником коротко-цепочечного альдегида - гептадиеналя (7:2n-3), продукта окислительного распада ЭПК, который определяет запах типичный для ракообразных (d'Hippolito G et al., Biochim Biophys Acta 2004, 1686, 100).
ДГК может окисляться по механизму описанному для АА в изопростан-подобные компоненты - нейропростаны (neuroprostanes), которые вероятно имеют большое значение при окислительном повреждении нейральных тканей и при образовании гидроксилированных производных – докозатриенов (docosatrienes) которые имеют антивоспалительный потенциал (резольвины, нейропротектины).
Редкие и необычные полиненасыщенные жирные кислоты.
Две необычные n-3 ЖК были описаны в культуре фибробластов человека, 14:3(n-3) и 16:4(n-3), как продукты катаболизма 20:5(n-3) в пероксисомах (Williard DE et al., J Lipid Res 1998, 39, 978). 16:4(n-3) была также идентифицирована в липидных экстрактах из губки Callyspongia sp (Urban S et al., Lipids, 1997, 32, 675). Необычная n-3 ПНЖК - 18:5 n-3 была выделена рафидофитовой водоросли Heterosigma akashiwo (Bell MV et al., Phytochemistry, 1997, 45, 303). Высокие концентрации 18:5n-3 обнаружены в некоторых микроводорослях: динофлягеллятах, празинофитьах, гаптофитах и рафидофитах (see Bell et al., 1997 for references). Предполагается, что эта кислота появляется как результат действия механизма укорачивания цепи 20:5n-3 как и образование 22:6n-3 из 24:6n-3. 18:5 n-3 является одним из наиболее достоверных хемотаксономических маркеров динофлягеллят. В настоящее время другие длинно-цепочечные ЖК - 28:7n-6 и 28:8n-3 также являются хемотаксономическими маркерами этих микроводорослей. Установлено, что 18:5n-3, как и 18:4n-3 у динофлягеллят локализована в гликолипидах фотосинтетического аппарата (Leblond JD et al., J Phycol 2000, 36, 1103).
В некоторых растениях (шпинат, табак и пресноводные водоросли) обнаруживают необычная триеновая ЖК (7,10,13-гексадекатриеновая кислота, 16:3n-3) и это позволило разделить растения на, так называемые "16:3-растения" (прокариот-подобные), и "18:3-растения". Эта кислота локализована главным образом в гликолипидах мембран хлоропластов. На примере некоторых ангиосперм примитивных растительных организмов, показно, что образование 16:3 n-3 является характеристическим признаком прокариотических организмов, таких как цианобактерии, микроводоросли, слизи, грибы, папоротники, хвойные и некоторые из эукариотических растительных организмов из низших таксономических групп.
Сверх длинноцепочечные (n-3) ЖК были описаны в липидах морского и пресноводного тюленя (Phoca hispida). Кислоты 23:5, 24:3, 24:4, 24:5, 24:6, 26:5, 26:6 and 28:7 были обнаружены в концентрациях не выше 0.2% (Kakela R et al., Lipids 1995, 30, 725). В офиурах (Оphiuroidea - Brittle star) кислота 24:6n-3 была обнаружена в концентрациях 3-15% от общих ЖК и ее идентифицируют главным образом в фосфолипидах (Takagi T et al., Lipids 1986, 21, 430; Kawasaki K et al., Fisheries Sci 2000, 66, 614).
Липиды сперматозоидов быка и барана особенно богаты сверх длинно цепочечными ПНЖК с числом атомов углерода от 30 до 34 с 6 двойными связями (Poulos A, Lipids 1995,30,1). Присутствие высоко ненасыщенных (n-3) ЖК (28:8n-3) было показано в липидах выделенных из динофлягелляты Crypthecodinium cohnii. Как и 22:6n-3 она содержит максимальное количество метилен разделенных двойных связей в углеродной цепи с 28 атомами углерода (Van Pelt CK et al., J Lipid Res 1999, 40, 1501). Эта и другие длинно цепочечные ПНЖК, например 28:7n-6, связаны с фосфолипидами, но не с гликолипидами (Leblond JD et al., J Phycol 2000, 36, 1103). Эти кислоты обнаруживают и в других динофлягеллятах - Prorocentrum micans (Mansour MP et al., Phytochemistry 1999, 50, 541) и через пищевые цепи они могут передаваться и обнаруживаются в рыбных жирах. Уникальный набор длинноцепочечных ПНЖК был обнаружен в динофлягелляте Amphidinium carterae, которые имели кислоты от С-22 до С-36 с от 3 до 7 двойных связей (Rezanka T et al., Phytochemistry 2008, 69, 2391).
До 1977 в большинстве литературных источников считалось, что бактерии не содержат ПНЖК с более чем с двумя двойными связями. Однако в 1977 году были обнаружены морские бактерии с высоким содержанием ЭПК (20:5n-3) (Johns RB et al., 1977). Позднее у 11 видов пьезофильных бактерий с глубин от 1200 до 10476 метров были найдены ЭПК и ДГК, причем их количество увеличивалось с глубиной (DeLong EF et al., Appl Environ Microbiol 1986, 51, 730). По всей видимости, присутствие этих ПНЖК связано в большей степени с адаптацией к низким температурам, чем к высокому давлению.
n-9 жирные кислоты
Среди кислот данной серии наиболее известной является триеновая 20:3n-9 кислота (кислота Меда), имеющая двойные связи при 5, 8 и 11 положении. Она была впервые открыта Klenk E. (Z Physiol Chem 1952, 291, 104 и 1955, 299, 74) в фосфолипидах мозга. Как стало известно позднее она может присутствовать в больших концентрациях в тканях животных, у которых в диете длительное время отсутствовали незаменимые n-6 ЖК (Holman RT, J Nutr 1960, 70, 405). Этот автор предложил использовать соотношение 20:3n-9 к 20:4n-6 как показатель дефицита эссенциальных ЖК. Недавно были опубликованы данныые о высоких количествах этой кислоты в хрящах некоторых животных – у птиц, млекопитающих и человека. Ее концентрации составляли до 5% в фосфолипидах хрящевых пластин и 16% в гиалиновом хряще цыпленка (Adkisson HD et al., FASEB J 1991, 5, 344). 20:3(n-9) составляет значительную часть ПНЖК в хрящах внутриутробного плода человека (Hamazaki T et al., Lipids 2009, 44, 97). Необычный геометрический изомер 22:4n-9 с транс двойной связью (цис-4,7,10,транс-13-докозатетраеновая кислота) была идентифицирована в фосфолипидах морского гребешка Pecten maximus (Marty Y et al., J Chromatogr A 1999, 839, 119). Она была сконцентрирована в плазмалогенной и диацильной формах фосфатидилсерина. Исследования по распределению этой кислоты показало, что цис-4,7,10,транс-13-22:4 представлена у всех организмов семейства Pectininae (Kraffe E et al., Lipids 2010, 45, 437).
Редкие жирные кислоты
Некоторые другие ПНЖК были описаны в липидах морских водорослей и они были использованы как хемотаксономические маркеры. Так, 16:2n-7, 16:2n-4 являются трассерами для диатомовых, 16:2n-6 и 16:4n-3 для хлорофитовых и 18:5n-3 для динофлягеллят (Viso AC et al., Phytochemistry 1993, 34, 1521). 18:5n-3 была открыта в 1975 (Joseph JD, Lipids 1975, 10, 395) в 11 видах фотосинтетических динофлягеллят и у некоторых ее концентрация достигала 20% от суммы ЖК (Gymnodinium, Peridinium, Massartia, Prorocentrum). Поскольку она также была обнаружена в липидах различных видов растительноядных копепод, то было предложено использовать 18:5n-3 в качестве трассера в морских пищевых цепях (Mayzaud P et al., Lipids 1976, 11, 858). В липидах семян Androsace septentrionalis (Primulaceae) (Tsevegsuren N et al., Lipids 2003, 38, 1173) и в некоторых видах семейства Sapindaceae (Spitzer V, Phytochemistry, 1996, 42, 1357) была идентифицирована необычная для растительных организмов 16:2n-4.
Другая необычная ЖК - 16:3n-4 является основной в галактозил диглицеридах морских диатомовых микроводорослей (d'Hippolito G et al., Biochim Biophys Acta 2004, 1686, 100). Показно, что она является источником коротко-цепочечного альдегида - октадиеналя (8:2n-4), который определяет защитную реакцию зоопланктона от хищников, питающегося диатомеями. 16:4n-1 (6,9,12,15-гексадекатетраеновая кислота) выделена из рыбного жира (Li D et al., Chromatographia 2012, 75, 1-6).
Себалиевая (sebaleic acid - 18:2n-10) обнаружена в липидах потовых желез (Nicolaides N et al., Lipids 1969, 4, 79), в волосах и волосяных луковицах человека (Destaillats F et al., J Chromatogr A 2011, 1218, 9384). Эта необычная кислота синтезируется только в клетках потовых желез элонгацией и десатурированием сапиеновой (sapienic acid - 16:1n-10) (Stewart ME et al., J Invest Dermatol 1986, 87, 733).
C-21 триеновая кислота (3,6,9-генитриен) и C-21 тетраеновая кислота (1,3,6,9-хенитетраен) выделены из липидов насекомых рода Arctiidae (Syntomoides imaon) и обладали активностью полового гормона (Matsuoka K et al., J Chem Ecol 2008, 34, 1437).
Необычная гексатриеновая кислота с концевой двойной связью алифатической цепи (16:3Δ9,12,15) была описана в семенах сорго Sorghum bicolor (Pan Z et al., J Biol Chem 2007, 282, 4326). Эта кислота участвует в формировании соргоолеона (липидного хинона), продукта, который является ингибитором развития проростков окружающих растений.
Все ПНЖК имеют низкую температуру плавления и подвержены окислительному распаду (автоокислению). UV радиация, высокие температуры, кислород, металлы и щелочные среда вызывают миграцию двойных связей, которые не разделены метиленовыми мостиками (коньюгированные двойные связи), автоокисляются и фрагментируются. В отличии от транс ЖК, коньюгированные кислоты не образуются в больших количествах в ходе промышленной гидрогенизации. Такие формы находят в желуках жвачных животных вследствии бактериальной ферментации. Первой стадией является изомеризация линолевой до, главным образом, до c9c11-18:2 катализируемой анаэробными бактериями Butyrivibrio fibrisolvens.
Коньюгированные диены
Позиционная изомеризация может происходить и в ПНЖК. Это преобразование характеризуется переходом изолированых двойных связей к структуре, в которой центры ненасыщенности расположены в непосредственной близости друг к другу. Сопряжение двойных связей рассматривается как промежуточный этап при перекисном окислении ПНЖК. Таким образом, конъюгированная линолевая кислота (термин, используемый для обозначения смеси позиционных и геометрических изомеров линолевой кислоты) является первым шагом к перекисному окислению линолевой кислоты.
Две двойные связи у двух основных изомерах конъюгированной линолевой кислоты (КЛК) располагаются главным образом при 9 и 11 и 10 и 12 атомах углерода. При этом каждая из двойных связей может быть как cis, так и trans конфигурации. Таким образом, было идентифицированно по крайней мере 8 различных изомеров КЛК. Из этих изомеров, c9, t11 считается наиболее распространенной природной формой обладающей биологической активностью. Она составляет 85-90% от общего содержание КЛК в молочных продуктах. Этот изомер получил название руменовая кислота (rumenic fatty acid) (Kramer JKG et al., Lipids 1998, 33, 835). КЛК впервые были выделены в 1983 году из мяса крупного рогатого скота и затем была определена их структура (Ha YL et al., Carcinogenesis 1987, 8, 1881). Они возникают естественным образом в рубце жвачных животных и присутствуют в большой концентрации в молоке, молочных и мясных продуктах (Ha YL et al., J Agr Food Chem 1989, 37, 75; Chin SF et al., J Food comp anal 1992, 5, 185). КЛК найдены в грудном молоке в количествах 0,12 - 0,15% от суммы ЖК (Luna P et al., Eur J Lipid Sci Technol 2007, 109, 1160), из которых более 60% в форме руменовой кислоты Jensen RG et al., Adv Exp Med Biol 2001, 501, 153). КЛК локализованы в sn-1 и sn-3 положении триглицеридов в жировой ткани баранов, однако если в рацион животных было добавлено подсолнечное масло, то КЛК локализовались во 2-ом положении триглицеридов (Paterson LJ et al., Lipids 2002, 37, 605).
Как было показано, КЛК образуются из линолевой кислоты и, главным образом, в виде двух изомеров, транс-10,цис-12 и цис-9,транс-11-КЛК через различные пути метаболизма. В то время как цис-9,транс-11 18:2 по всей видимости метаболизирует до 20:4, транс-10, цис-1218:2 трансформируется главным образом до цис-6,транс-10,цис-12 18:3 (Sйbйdio JL et al., Lipids 2001, 36, 575). Таким образом, изомеры КЛК рассматриваються как новое семейство ПНЖК (Banni S et al., Lipids 2004, 39, 1143). КЛК найдены в триглицеридах, фосфолипидах и липопротеинах человека. Они синтезируются из линолевой кислоты через биогидрогенезацию и ферментативную изомеризацию бактериями в рубце жвачных животных и по пищевым цепям передаются человеку. Они стабильны при хранении и термообработке пищи.
Интерес к КЛК повысился после работы (Ha YL et al., Carcinogenesis 1987, 8, 1881) в которой были показаны антикарценогенные свойства. Затем были описаны и гипохолистерилемические эффекты. Они способствовали снижению ожирения и модулировали иммунный ответ в некоторых животных моделях. Два изомера, транс-10,цис-12 и цис-9,транс-11 18:2 в зависимости от используемых моделей оказывали различные эффекты. Оба изомера показали высокий уровень антиканцерогенной и антиатерогенной активности, но снижение веса вызывал только транс-10,цис-12 КЛК (Pariza MW et al., Prog Lipid Res 2001, 40, 283). Противоположные эффекты цис-9,транс-11 и транс-10,цис-12 18:2 были описаны в крови здорового человека (Tricon S et al., Am J Clin Nutr 2004, 80, 614). Среди всех изомеров, цис-9,транс-11 18:2 показали наибольшую активность в ингибировании пролиферации нормальных и лейкемических клеток (Lai KL et al., Lipids 2005, 40, 1107).
Биологическая активность КЛК исследовалась на животных моделях некоторых заболеваний человека и культурах клеток. Были описаны эффекты на иммунные функции, метаболизм липидов и эйкозаноидов, образование цитокинов и иммуно-глобулинов и на многие другие метаболические процессы. Так как большинство исследований были проведены с использованием смеси изомеров на животных моделях, эти наблюдения должны быть обоснованы, прежде чем они могут быть использованы в медицине (Wahle KW et al., Prog Lipid Res 2004, 43, 553). КЛК, как и другие сопряженные ЖК, обладают антиоксидантной активностью, которая может быть связана с их антиканцерогенными и анти-атеросклеротическими эффектами (Yang L et al., J Agric Food Chem 2009, 57, 4212).
С обзором о происхождении и физиологических свойствах транс ЖК и КЛК можно познакомиться в работе (Fritsche J et al. Fett/Lipid 1998, 100, 190), или на веб сайтахudoerasmus.com и Dr Christie. Обзор литературы по физиологическим аспектам действия КЛК у человека представлен (Terpstra AHM Am J Clin Nutr 2004, 79, 352). После более чем сотни работ, которые были опубликованы ранее, определенного вывода о безопасности КЛК не представлено, несмотря на то, что они могут иметь благоприятные последствия для здоровья человека (Benjamin S et al., Nutr Metabol 2009, 6, 36). Масштабное исследование по определению содержания транс ЖК в пищевых продуктах и степень их усваивания было проведено во Франции в 2007 (Laloux L et al., Eur J Lipid Sci Technol 2007, 109, 918). Тем не менее в соответствии с рекомендациями FAO их содержание в пищевых проуктах должно быть минимальным.
Изомеры КЛК - транс-9,транс-11, цис-9,транс-11, и транс9,транс-11 18:2 могут быть получены химическим способом – щелочной изомеризацией линолеата (Scholfield CR et al., JAOCS 1970, 47, 303). Смесь (72% цис-9,транс-11 и 26% цис- 9,цис-11 18:2) было получено через катализируемое калиевой щелочью (KOH) дегидрирование рицинолевой кислоты при 80°C с 77% выходом (Yang L et al. Chem Phys Lipids 2002, 119, 23). Транс-10,цис-12 изомер может быть получен из смеси изомеров посредством низко-температурной кристаллизации с последующим осаждением мочевиной (Kim SJ et al., J Food Sci Nutr 2000, 5, 86). Транс-,транс изомеры линолевой кислоты можно получить метилированием с BF3 в метаноле в контролируемых условиях (Kim SJ et al., J Agric Food Chem 2003, 51, 3208).
Коньгированные полиены
Коньгированные ПНЖК, главным образом С-18 триены или тетраены обнаруживаются некоторых растительных маслах. Масла, содержащие эти кислоты очень востребованы при производстве органических полимерных покрытий, поскольку коньюгированные полиены быстро полимеризуются и обладают адгезивными свойствами. Коньюгированные триены (цис-,транс-,транс- и транс-,транс-,транс-) образуются при термической обработке коммерческих пищевых растительных масел (Kinami T et al., JAOCS 2007, 84, 23). К этим C-18 кислотам также относится сорбиевая или 2,4-гексадиеновая кислота (sorbic acid), которая была открыта в 1859 AW von Hofmann в ягодах (Sorbus aucuparia). В 1930 годах ее стали использовать в качестве консерванта пищевых продуктов. Сорбиевая кислота и ее натриевая или кальциевая соли обладают антимикробной активностью, ингибирует рост дрожжей, грибов. В пищевой промышленности они известны как пищевые добавки E200, E201, E202, E203.
Коньюгированные октадекатриеновые кислоты:
Календовая кислота (Calendic acid – транс-8,транс-10,цис-12 18:3) была обнаружена в семенах Calendula officinalis (до 60%) (Chisholm MJ et al., JAOCS 1966, 43, 391).
Каталпиковая кислота (Catalpic acid – транс-9,транс-11, цис-13 18:3) составляет до 50% от общих ЖК в масле из Catalpa ovata и C. Bignonoides (Ozgьl-Yьcel S, JAOCS 2005, 82, 893). Липиды из семян Catalpa ovata подавляет химически индуцированную пролиферацию клеток прямой кишки крыс, как полагают за счет катапиковой кислоты (Suzuki R et al., Oncol Rep 2006, 16, 989).
α-Элеостеариновая кислота (α-Eleostearic acid – цис-9,транс-11,транс-13 18:3) составляет >65% от общих ЖК масла тунгового дерева (Aleurites fordii) семействаEuphorbiaceae), которое является единственным коммерческим источником и имеет большое промышленное значение. Изомер (транс-9,транс-11,транс-13 18:3) был найден в растительных маслах из Momordica charantia (8%), Catalpabignonoides (8.5%)и Punica granatum (21%) (Ozgьl-Yьcel S, JAOCS 2005, 82, 893). α-Элеостеариновая кислотатакже найдена в больших количествах (около 65%) в семенах Parinarium excelsum (Miralles J et al. Fatt Sci Technol 1994, 96, 64). Исследования по распределению этой кислоты в растениях показало, что оно характерно семейства Chrysobalanaceae, в то время в семействе Rosaceae только один вид (Prunus mahaleb) показал наличие этой кислоты (JAOCS 2005, 82, 893). Диетологические эксперименты показали, что эта ЖК может влиять на уровень липидов в крови крыс (Dhar P et al., Lipids 1999, 34, 109).
Жакариевая кислота (Jacaric acid - 8c10t12c-18:3) найдена в семенах Jacaranda mimosifolia.
Пунициевая кислота (Punicic acid - 9c11t13c-18:3) известна как трикозановая кислота из семян Punica granatum и Momordica charantia (Punicaceae), из семян Trichosanthes anguina (Cucurbitaceae) и из семян Punica granatum (до 65% от суммы кислот). Необычный триглицерид с двумя пунициевыми кислотами был выделен из семян (Punica granatum) (Yusuph M et al., Phytochemistry, 1997, 44, 1391). Как было показано, эта кислота действует как про-оксидант и анти-оксидант в зависимости от количества в диете, снижает уровень холестерина (Mukherjee C et al., J Oleo Sci 2002, 51, 513). Также показано, что эта кислота ингибирует агрегацию и метаболизм АА в тромбоцитах (Takenaga M et al., Prostaglandins Leukot Essent Fatty Acids. 1988, 31, 65) и подавляет химически индуцированный карциногенез прямой кишки крыс (Kohno H et al., Cancer Sci 2004, 95, 481).
Другая коньюгированная кислота – румелиновая (rumelenic acid - 9с,11t,15c 18:3) была описана как компонент жиров жвачных животных и образуется в рубце (Destaillats F et al., J Dairy Sci. 2005, 88, 3231). Изомер (цис-9,транс-13,цис-15 18:3) был определен в низких концентрациях в молочном жире. Метиловый эфир транс-2,цис-4,цис-6-10 18:3 является специфическим соединением определяющим пол у растительноядного клопа Thyanta pallidovirens (Millar JG, Phytochemistry, 1997, 38, 7971).
Коньюгированный тетраен из Parinarium sp (Rosacae) и Impatiens balsamina, паринариевая кислота (α-parinaric – цис-9,транс-11,транс-13,транс- и β-parinaric – транс-9,транс-11,транс-13, транс-15 18:4n-3) используется в биофизических исследованиях для измерения подвижности липдного бислоя в мембранах. Оба изомера были открыты в 1933 (Tsujimoto M et al., J Soc Chem Ind Japan 1933, 36, 110B) и в 1935 году определена их структура (Farmer EH J Chem Soc 1935, 759).
Две новых эйкозапентаеновые кислоты – цис-5,транс-7,транс-9,цис-14,цис-17 и транс-5,транс-7,транс-9,цис-14,цис-17 20:5 были определены в виде свободных кислот в липидных экстрактах из красной морской водоросли (Ptilota filicina), (Lopez A et al., Lipids 1987, 22, 190). В морской зеленой микроводоросли Anadyomene stellata была обнаружена новая С-20 полиеновая кислота с 4-мя коньюгированными двойными связями. Пять коньюгированных ЖК с различной длинной цепи и ненасыщенностью были описаны: 16:5, 18:4, 20:5, 20:6 и 22:7. У всех этих кислот имеется общий элемент - 4 коньюгированных с полностью цис- двойными связями, как и у 18:4 с цис- двойными связям в 6,8,10,12 положении. К ряду коньюгированных кислот можно отнести и докозагептаеновую кислоту, с двойными связями в 4,7,9,11,13,16,19 положении – стеллагептаеновая кислота (stellaheptaenoic acid) (Mikhailova MV et al., Lipids 1995, 30, 583).
Полиметилен-разделенные полиеновые кислоты
Среди ненасыщенных полиметилен-неразделенных ЖК, известных как метилен-неразделенные ЖК, с цис-5 этиленовой связью (Δ5-олефиновые кислоты) были обнаружены в различных растительных липидах и они являются характерными для липидов семян Голосеменных (Wolff RL et al., J Lipid Res 1996, 73, 765). В роде Pinus, как и у всех представителей семейства Pinaceae были обнаружены Δ5-ненасыщенные полиметилен неразделенные ЖК (Wolff RL et al., Lipids 2000, 35, 1). Эти кислоты имеют сходный структурный элемент, как у таксолиевой кислоты (taxoleic acid – цис-5,цис-9 18:2),пиноленовая (pinolenic acid – цис-5,цис-9,цис-12 18:3) и сциадоновая кислоты (sciadonic acid - цис-5,цис-11,цис-14 20:3) были найдены в орехах голосеменных (Taxaceae, Teucrium) и в таловом масле (продукт возгонки стволов сосны). В маслах из орехов эти кислоты содержатся в концентрациях от 1% до 25%. Пиноленовая кислота из орехов сосны корейской (Pinus koraiensis) была выделена и посредством ряда процедур получена в чистом виде (Lee JW et al., Lipids 2004, 39, 383). Исследования показали, что пиноленовая кислота снижает уровень липопротеинов в печени и уровень триглицеридов в плазме крови у крыс (Asset G et al., Lipids 1999, 34, 39). Сциадоновая кислота 5,11,14-20:3 была обнаружена в семенах и листьях всех исследованных растений семейства Coniferophytes (включая кониферы и гинкоиды) (Wolff RL, JAOCS 1999, 76, 1515). Диагностическим признаком для этого семейства является относительно высокое содержание Δ5-олефиновых кислот, что делает их очень полезными для питания человека (Destaillats F et al., J Agric Food Chem 2010, 58, 2082). Двойные связи в положении Δ5,9 включая и короткоцепочечные аналоги Δ5,9-16:2 и Δ5,9-18:2 были обнаружены в липидных экстрактах некоторых слизей. Новая триеновая ЖК Δ5,9,12-17:3 была выделена из клеток слизи Polysphondylium pallidum (Saito T et al., Lipids, 1996, 31, 445). Продукт элонгации таксолиевой кислоты – дигомотаксолиевая (7,11-20:2) выделена из липидов семян семейства Taxus, которая содержит и большое количество таксолиевой кислоты Δ5,9-18:2 (Destaillats F et al., Lipids 2001, 36, 319).
Бутилен разделенная диеновая кислота в мякоти манго (Mangifera indica) имела структуру Δ9,15 18:2. Ее количество составляло 5.4% от общих ацильных радикалов в липидах (Shibahara A et al., Biochim Biophys Acta 1993, 1170, 245). Новая бутилен разделенная октадекатриеновая кислота Δ3,9,12 18:3 (6.9%) была выделена и семян хризантемы (Chrysanthemum zawadskii).
У низших животных группа ЖК от C-18 до C31 кислот широко представлена в губках и для них характерна Δ5,9c ненасыщенность, что вероятно связано с их функциональностью. Эти компоненты представлены как в пресноводных, так и в морских губках класса Demospongia и они поэтому они известны как демоспонгиевые ЖК - Δ5,9,17-26:3, Δ5,9,21-28:3 и Δ5,9,23-30:3 (Review in : Dembitsky VM et al., Chem Phys Lipids 2003, 123, 117). Например, в губке Verongia aerophoba были определены структуры 12 ЖК представляющих гомологичный ряд от Δ5,9,22 до - Δ5,9,22 29:3) (Nechev J et al., Eur J Lipid Sci Technol 2002, 104, 800). Было показано, что горгониевые коралла также содержат демоспонгиевые кислоты, что обьясняется присутствием в кораллах симбиотических губок (Imbs AB et al., Lipids 2009, 44, 325). При антиплазмоидальных биооиспытаниях показана высокая антипротозойная активность для ЖК от С-23 до С-26 и расположением двойных связей в положении Δ5,9 (IC50 : 12-16 мкг/мл) (Carballeira NM, Prog Lipid Res 2008, 47, 50). Механизм действия этих соединений неясен и интесивно исследуется (Tasdemir D et al., Bioorg Med Chem 2007, 15, 6834). Таким образом ЖК губок могут быть источником очень активных антигрибковых препаратов и эффективных противораковых препаратов. Демоспонгиевые кислоты, как правило, преобладают в фосфолипидах и, особенно, в амино-фосфолипидах) (Lawson MP et al., Lipids 1988, 23, 741) подтверждая гипотезу о необычной специфической структуре клеточных мембран у губок. Однако не только губки имеют в своем ЖК составе Δ5,9 диеновые кислоты, подобные структуры находят и в других морских организмах, например: в зоонтариях и анемонах. Высказано предположение, что в происхождении этих ЖК участвуют симбиотические бактерии, которые живут и взаимодействуют с хозяином в биосинтезе ЖК. Две триеновые кислоты Δ5,9,15-22:3 and Δ5,9,15-24:3 были идентифицированы в триглицеридах гонад моллюсков (Kawashima H, Lipids 2005, 40, 627). Демоспонгиевые кислоты могут находиться не только в составе фосфолипидов или триглицеридов, так кислота 5,9,23-30:3 присутствовала в виде метиловых эфиров в губке Chondrilla nucula (Meyer M et al., Lipids 2002, 37, 1109).
На основе распределения Δ5,9 ЖК можно заключить, что биосинтетические пути у безпозвоночных, губок, миксомицетов и некоторых растительных организмов имеют сходные ферментативные ситемы для синтеза Δ5,9 метилен не разделенных диеновых кислот (Kornprobst JM et al., Mar Drugs 2010, 8, 2569). Авторы показали, что демоспонгиевые кислоты могут являться продуктами биосинтеза элонгазами и Δ5 и Δ9 десатуразами на субстраты - такие как пальмитиновая и пальмитолеиновая кислоты.
Четыре типа метилен не разделенных ПНЖК были найдены в липидных экстрактах в концентрациях 2-13% в полярных и нейтральных липидах у морских звезд Ophiuroidea (Brittle star) – транс-7, транс-13 20:2; транс-7, транс-13,цис-17 20:3; цис-9,цис-15,транс-19 22:3 и транс-4,цис-9,цис-15, транс-19 22:4 (Sato D et al. J Oleo Sci 2002, 51, 563). В липидах гонад моллюсков были идентифицированы 5,11-19:2; 7,16-21:2; 9,15-24:2; 5,11,14,17-20:4 и 7,13,16,19-22:4 (Kawashima H, Lipids 2005, 40, 627). Значительное количество диеновых не-метилен разделенных ЖК было обнаружено в липидах морских моллюсков и иглокожих в количествах до 20% в полярных липидах клеточных мембран (Barnathan G, Biochimie 2009, 91, 671).
Необычные n-4 не метилен разделенные ЖК были выделены из липидов моллюска Calyptogena phaseoliformis, живущего в глубоководных гидротермальных вентах (Saito H, J Chromatogr A 2007, 1163, 247). Наряду с 7,15-20:2; 7,16-21:2; 5,13,16-20:3 и 1,4,7,15-20:4, были идентифицированы 4,7,15-20:3 и 4,7,16-21:3. Происхождение этих небычных ЖК обусловлено симбиотическими хемосинтетическими бактериями использующих геотермальную энергию и питающихся пищей геотермального происхождения в вентах (Saito H, J Chromatogr A 2008, 1200, 242). Не метилен разделенные ЖК имеющих структуру 7,15-22:2 и 9,13-18:2 выделены из морского моллюска Crepidula fornica (Dagorn F et al., 2009). При омылении высоконенасыщенных липидов из Mycobacterium phlei были определены ЖК с С-36 атомами углерода – гексатриаконта - 4,8,12,16,20-пентаеновая или плеивая кислота. Путь ее биосинтеза был приведен в работе (Asselineau CP et al., Eur J Biochem 1976, 63, 509).
Алленовые жирные кислоты
Алленовые кислоты содержат (-CH=C=CH-) группу. Первая алленовая структура в ЖК лаббелиновая кислота (laballenic acid - 5,6-октадекадиеновая кислота) была идентифицирована в липидах семян Leonotis napetaefolia (Labiateae) (Bagby MO et al., J Org Chem 1965, 30, 4227). Две C-18 алленовых кислоты описали в липидах семян других представителей семейства Labiateae: 5,6-18:2 (лаббелиновая кислота) и 5,6,16-18:3 (ламеналленовая кислота) (Hagemann JM et al., Lipids 1967, 2, 371).
Триеновые алленовые кислоты с 14 атомами углерода (2,4,5-14:3) является половым феромоном у некоторых насекомых. Гидрокси алленовая кислота (hydroxy allenic acid - 8-гидрокси-5,6-октадиеновая кислота) была описана в эстолидах некоторых растений. В обзоре об алленовых кислотах можно получить исчерпывающую информацию об этих и других кислотах (Dembitsky VM et al., Prog Lipid Res 2007, 46, 328).
Кумуленовые жирные кислоты
Кумуленовая кислота содержит в цепи 3 сопряженные двойные связи (–HC=C=C=CH–). Первые кумуленовые кислоты, такие как γ-лактоны 2,4,6,7,8-ддекапентаеновая и 4-гидрокси-2,4,5,6,8-декапентаеновая кислоты были выделены из некоторых растений семейства Asteraceae (Bohlmann F et al., Chem Ber 1971, 104, 1329). 2,6,7,8-декатетраен-4-иновая кислота, 9-(метилтио)-, был также выделена из Anthemius austriaca (Asteraceae). Другие кумуленовые кислоты, такие как- 2,3,4-декатриеновая кислота была выделена из семян Matricaria inodora.
Полный список наименований жирных кислот можно найти у (Adlof R.O. and Gunstone F.D.), а их структура и источники происхождения могут быть найдены на веб-страницах AOCS Analytical Division. и Instituto de la Grasa.
База данных по исследованиям растительных масел и ЖК составу 15,738 видов семян доступна в Интернете на сайте "New crops". Эти данные собирались в National Center for Agricultural Utilization Research в течение ряда лет для оценки новых потенциальных источников пищевых и технических жиров из растительных организмов.
Важные базы данных о липидах доступны в Интернете на сайте информационно-поисковой системы Lipid Bank for Web. Этот сайт содержит информацию о ЖК, а также физические и химические характеристики о различных жиров и масел.
Наиболее полно представлены различные данные о ЖК в Institute for Chemistry and Physics of Lipids in Munster, которые собирались и систематизировались с 1970 года. Электронная поисковая система предлагает разнообразные процедуры поиска и просмотра около 110 000 индивидуальных данных, относящихся к более чем 7 000 различным видам растений (Aitzetmuller K et al., Eur J Lipid Sci Technol 2003, 105, 92). В ней перечислены более 500 различных ЖК растительного происхождения и система позволяет осуществлять поиск видов растений, родов и семейств по отдельным ЖК, так и в составе различных масел. Авторы приводят ссылки на литературу и на многочисленные неопубликованные данные, описывают структуру и функциональные группы некоторых ЖК.
Полезная и информативная база данных о физико-химических свойствах ЖК, собранная из литературы и собственных исследований Авторов приводится в работе (Guendouzi A et al., Chem Phys Lipids 2012, 165, 1-6). Графические данные о окислительном распаде жирных кислот можно найти на сайте BioCarta.
Для спасения жизней
Всемирная Организация Здравоохранения первое десятилетие 21 века провозгласила декадой костей и суставов. Суставной синдром, то есть боли в суставах, поражение их структур, наблюдается более чем при 200 заболеваниях и синдромах. После гнойных (вызванных болезнетворными бактериями) артритов необратимая утрата функции сустава происходит у 25%-50% пациентов! От 5 до 15% заболевших – умирают! Страшная статистика. Вот почему, почувствовав боль в суставе, а особенно боль, сопровождающуюся повышением температуры тела, необходимо не заниматься самолечением, а как можно скорее обратиться к компетентному врачу.
Мы беседуем с Александром Ивановичем ДУБИКОВЫМ, заведующим ревматологическим отделением Владивостокской клинической больницы №2, заведующим кафедрой ревматологии Владивостокского государственного медицинского университета, профессором, доктором медицинских наук.
– Александр Иванович, выражена ли возрастная зависимость ваших пациентов?
– Я бы не сказал, что это проблема общего старения населения. Потому что среди тех, кто обращается к нам, лидируют пациенты среднего возраста, в частности, с заболеваниями позвоночника. Они же являются основными поставщиками молодых инвалидов по причине ревматических заболеваний. Поэтому эта актуальность не касается только престарелого населения. Вообще это миф о том, что вторая половина жизни человека связана с проблемами с суставами. – Ничего подобного! Ревматическими болезнями болеют дети, люди зрелого, пожилого и старческого возраста. Практически исключения по возрастам нет никакого. Все зависит от типа заболевания. Допустим, если мы говорим о воспалительных заболеваниях суставов, то это в основном средний, молодой возраст. А если мы говорим о дегенеративно-дистрофических заболеваниях, то это преимущественно возраст пожилой и старческий.
– Кто ваши пациенты в большей степени – мужчины или женщины?
– Доминируют женщины. Ревматические болезни, если так можно выразиться, «любят женщин». Например, ревматоидный артрит. Хотя есть заболевания, при которых преимущественно страдают мужчины. Это группа с анкилозирующим спондилоартритом, в частности, болезнь Бехтерева. При этом заболевании воспаление сочленений и суставов позвоночника ведет к известкованию и развитию анкилоза – неподвижности.
– Какова динамика числа заболеваний за последние годы?
– Отмечается медленный, но неуклонный рост числа заболевших. К слову, отчасти рост может быть объяснен тем, что улучшается диагностика и, соответственно, выявляемость заболеваний. Мы проводим круглые столы со специалистами, читаем лекции для врачей других специальностей. Уровень знаний, оснащенность медицинским оборудованием и приборами, информированность врачей растут и, соответственно, чаще больные на ранних стадиях заболевания отправляются на лечение.
Но некоторые заболевания фактически исчезли из медицинской практики.
– Например?
– Системные мускулиты, при которых поражаются сосуды разного калибра всех органов и систем. Есть такое заболевание как узелковый полиартрит. Оно известно давно, описано еще несколько веков назад, это заболевание считалось фатальным, то есть такой диагноз означал приговор. Долго пытались расшифровать его причиноагенты. Одним из них оказался вирус гепатита Б. Болезнь характеризовалась острым течением, с такими вот внепеченочными проявлениями. Когда был расшифрован причиноагент, этиология заболевания, было подобрано адекватное лечение. Количество пациентов сократилось, и теперь я даже не скажу точно, когда в последний раз мы ставили диагноз – узелковый полиартрит.
– С чем это может быть связано?
– Отчасти, с широкой вакцинацией населения против гепатита А, Б.
Это классический пример. Что еще исчезло? Так называемая группа реактивных артритов на фоне мочеполовой инфекции. Этому способствовал широкой безрецептурный отпуск антибиотиков в связи с лечением инфекций, что могло предотвращать осложнения в виде поражения опорно-двигательного аппарата. Чего стало много? В связи с тем, что изменился стереотип питания, двигательной активности людей, увеличивается ассортимент не совсем качественных и здоровых продуктов питания, мы отмечаем значительный рост подагры. Подагра сегодня просто буйствует!
– Есть ли отличия от ситуации с аналогичными заболеваниями в других странах?
– Вспоминаю статистику, представленную на очередном европейском конгрессе группой американских врачей, – похожий процесс и те же тенденции.
– Значит, нужно озаботиться правильным питанием?
– Прежде всего, посмотреть состав продуктов. Например, сейчас покупателю предлагается огромное количество прохладительных напитков. В их многообразии трудно ориентироваться даже специалисту по рекламе. Но все их объединяет высокое содержание фруктозы. Раньше считалось, что фруктоза лучше, чем глюкоза, в том смысле, что предотвращает возможность развития сахарного диабета, изменения чувствительности инсулиновых рецепторов к инсулину на фоне таких продуктов… Но коварство этого вещества сказалось в другом: оказывается, большое содержание фруктозы в организме приводит к резкому повышению уровня мочевой кислоты – основного показателя склонности к подагре. И это сразу же дало о себе знать.
Поэтому обращайте внимание на качественный состав продуктов. Фруктоза – естественный компонент натуральных продуктов, но его нельзя употреблять в огромных количествах. Съесть столько фруктов – не в человеческих силах, а выпить концентрат – пожалуйста!
– Александр Иванович, расскажите о себе. Как складывался ваш путь в медицину?
– Я окончил Владивостокский государственный медицинский институт. В 1983 году прошел интернатуру, специализировался на внутренних болезнях, а остановился на ревматологии.
– Чем трудна ваша работа, от чего больше всего устаете?
– Особенности нашей профессии состоят в том, что мы сражаемся на невидимом фронте: работаем с бедами, катастрофами в личных жизнях пациентов и их родственников. Не всегда борьба за здоровье, жизнь пациента заканчивается нашей победой, порой в финале всех наших и пациента усилий – его смерть.
В результате, спустя двадцать лет нелегкой работы, понимаешь, что у тебя за плечами – кладбище… Это, конечно, неприятная тема, врачи не любят ее обсуждать. Ощущаешь тяжкий груз, все время возвращаешься к этим ситуациям, обдумываешь их, решая, правильно ли поступил тогда, как можно было бы поступить сейчас? Врачам, от действий которых зависят жизни пациентов, не удается проработать до пенсии, не почувствовав себя виновным в смерти хотя бы одного человека.
Можно всю жизнь проработать, не беря на себя тяжкий груз ответственности за принятие решений, от которых зависит жизнь больного. Но в этом случае ты не спасешь жизнь ни одного человека. Если сам принимаешь трудные решения, то ошибки и тягостные мысли всегда с тобой.
–В чем еще сложность вашей профессии?
– Она – не в технических особенностях новейшего оборудования. Мы, врачи, работаем с человеком, венцом творения природы. Его организм сложен, многофункционален и понят, к сожалению, весьма поверхностно. Не требуйте от врача невозможного – точного знания лечения всех заболеваний.
Сложность нашей работы еще и в общении с пациентами, с их родственниками, потому что мы все люди – разные.
– Почему болеют врачи, ведь они все знают про болезни?
– Врачи, действительно, знают многое, но редко уделяют себе достаточно внимания. Тот, кто имеет основным источником дохода профессию врача, должен много работать. Уж такова социально-экономическая ситуация в стране. Человеку практически не остается времени ни на личную жизнь, ни на то, чтобы следить за своим здоровьем.
– В случае заболевания лечите себя самостоятельно?
– Целесообразно поручить лечение другому врачу, потому что в отношении себя трудно объективно оценивать ситуацию и принимать верные решения. В этом смысле, лечить родственников – неблагодарное занятие. Вы удивитесь, но часто результат получается хуже, чем при лечении обычного пациента. Есть такое шутливое правило: «Бойся рыжих, больных и своих».
– Легко ли уживаются врач и администратор в одном человеке?
– Очень нелегко. За два десятилетия сфера управления в медицине изменилась до неузнаваемости. В нее нужно погружаться целиком, и жить в ней как рыба в воде. А поле деятельности врача требует других компетенций.
– Что отличает Владивостокскую клиническую больницу №2 от других медицинских учреждений Владивостока?
– Не только то, что она самая большая, сейчас здесь 862 койки, при открытии было – 1200. Эта больница – единственная, которая работает в круглосуточном режиме скорой медицинской помощи по хирургическим профилям. В этих стенах работа здесь не останавливается ни на секунду.
– Больница большая, в моем восприятии – даже устрашающая.
– Слабые стороны больницы определяются тем, что она построена в последней четверти прошлого века по проекту, к тому времени уже морально устаревшему. Неудивительно, что сегодня по своим архитектурным особенностям, организации потоков пациентов больница не соответствует требованиям, предъявляемым современной клинике.
А сильные стороны – в стабильном коллективе высокопрофессиональных специалистов, способных работать в условиях неотложной медицины. Приведу такой пример. В 1992 году горели и взрывались склады боеприпасов арсенала, расположенного в районе Второй Речки. Там, в частности, были самонаводящиеся снаряды, ракеты. Больница внезапно оказалась в зоне бомбардировки, и когда это случилось, все пациенты были эвакуированы в течение нескольких часов. Представьте себе, каких сил это стоило! Среди больных были травмированные, зафиксированные на вытяжке, очень «тяжелые» пациенты в терминальной стадии, не подлежащие транспортировке. Но все они, сто с лишним человек были размещены в убежище, расположенном рядом с больницей и пробыли там трое суток. Мы все это время находились рядом с ними, и лечение не прекращалось. Другие, лучше оснащенные стационары города, дали согласие на прием эвакуированных пациентов при условии, что рядом будут находиться наши специалисты. Большие стационарные планы, – норма для нас, – непривычны для других больниц, в которых медицинский персонал хирургического, травматологического профиля работает в более щадящих режимах.
– Как вам работается в женском коллективе?
– Работа в однополом, особенно в женском коллективе, имеет свою специфику. Особенности женской психологии невозможно отменить приказом, да это и не нужно. Но мне с коллективом повезло, мы не только дружно работаем, но и отдыхаем вместе вне работы.
– Участвуете ли вы и врачи отделения в учебном процессе?
– Конечно, потому что мое основное место работы сейчас – руководство кафедрой факультетской терапии ВГМУ. В больницу я пришел на заведование кафедрой, по совместительству руковожу городским ревматологическим центром. Ряд моих сотрудников тоже совмещают лечебную работу с преподаванием.
В медицине обучение и лечебная деятельность неразрывны. Все крупные стационары города являются клиническими базами кафедр. Кафедры занимаются не только обучением студентов, но и последипломным повышением квалификации врачей-интернов, ординаторов и так далее.
– Александр Иванович, сотрудничаете с учеными Дальневосточного отделения РАН?
– Мы не располагаем такой современной аналитической, приборной базой как институты ДВО РАН, поэтому сотрудничество с ними – великое благо для нас. Другой альтернативы для проведения фундаментальных исследований я не вижу.
Немногим более десятка лет мы работаем вместе с Институтом биологии моря имени А.В. Жирмунского ДВО РАН. Впечатляющие изменения происходят на моих глазах год за годом, особенно, с приходом в ИБМ молодого директора – академика Андрея Владимировича Адрианова. Институт преображается внешне, лаборатории оснащаются современным оборудованием, а уровень выполняемых исследований – выше всяких похвал! Очень правильно, что новейшие приборы загружены полностью – работают в режиме коллективного пользования.
Непосредственно в институте мы работаем с Мариной Геннадьевной Елисейкиной, Инессой Валерьевной Дюйзен. Проводим тонкие гистохимические исследования. Используем такие методы как электронная микроскопия, конфокальная микроскопия, электронная иммунохимия. Но современные методы и совершенное оборудование бесплодны без чутких рук оператора и умения правильно интерпретировать полученный результат. Вот за это я ценю сотрудничество с ИБМ ДВО РАН. Считаю, что совместная работа медиков и ученых приносит пользу обеим сторонам.
– Используете ли вы в клинических условиях биопрепараты, разработанные в институтах ДВО РАН?
– Сегодня в институтах ДВО РАН создано много перспективных препаратов. Чтобы зарегистрировать их в качестве лекарственных, потребуются большие финансовые затраты. Биологически активные добавки регистрируются значительно дешевле и проще, но нормативами запрещено проводить клинические исследования с БАДами. Таков порядок.
Мы, к примеру, сотрудничаем с учеными ИБМ, которые занимаются выделением липидов из морских гидробионтов и изучают механизмы их действия на организм животных и человека. Липиды с простой эфирной связью, алкил-глицериновые эфиры, проявляют сильнейшие гемопоэтические, иммуностимулирующие, противораковые, радиопротекторные свойства, улучшают функциональное состояние опорно-двигательного аппарата. Препараты на их основе производят из дорогостоящего акульего жира, но в условиях экспериментально-технологического участка ИБМ нашли способ получать эти вещества в чистом виде, без примесей из печени дальневосточного моллюска. При промышленной добыче его внутренности просто выбрасывают за борт. Нам интересен результат приема пациентами препарата БАД «Липидомарин» на основе алкил-глицериновых эфиров в разных режимах дозирования, мы пытаемся оценить некоторые клинические эффекты. Но провести полноценные клинические исследования нельзя до тех пор, пока препарат не будет зарегистрирован как лекарственный.
За рубежом, в Соединенных Штатах Америки, впервые было выполнено огромное исследование применения БАДов при лечении заболеваний суставов. В конце концов, кто-то решился на это. Но я представляю себе, как это было сложно сделать.
– Помимо Института биологии моря, с какими институтами сотрудничаете?
– С учеными Дальневосточного геологического института мы изучаем процессы минерализации хряща при особой группе заболеваний суставов. Поэтому нам понадобилась помощь лаборатории рентгеновских методов исследований, которую возглавляет кандидат геолого-минералогических наук Александр Александрович Карабцов. Мы работаем вместе уже больше года и получили уникальные результаты, которые сейчас готовим к публикации. Я могу сказать, что вначале у сотрудников лаборатории был определенный скептицизм, какие такие минералы мы ищем в органическом хряще? А когда получили результаты, – удивились, потому что обнаружили минералы классического состава.
В Тихоокеанском институте биоорганической химии ДВО РАН сотрудничаем с лабораторией неинфекционного иммунитета, которую возглавляет профессор, доктор биологических наук Павел Александрович Лукьянов. Мы приступили к исследованию процессов нейроиммунологического характера при заболеваниях опорно-двигательного аппарата.
Результаты всех этих исследований пока что не применимы в лечении, но определяют очень важные направления развития медицины и биологии. Быструю отдачу могли бы дать клинические исследования с субстратами, полученными в лабораториях институтов ДВО РАН, потому что там есть много хороших наработок. Вот только регистрация препарата как лекарственного обходится в сумму до 300 тысяч долларов. Где академическому институту взять такие деньги, если за ним не стоят фармацевтические транснациональные гиганты, которые определяют всю политику проведения исследований в отрасли?
Один из российских олигархов как-то сказал, куда должны идти те, у кого нет миллиарда рублей… Ничего личного, это просто конкурентная борьба.
– Расскажите о внедрении в практику современных методов оказания медицинской и лекарственной помощи.
– Сегодня процессы глобализации наложили отпечаток на все стороны нашей жизни, и мы практически работаем по международным протоколам или консенсусам. Мы точно так же лечим болезни, как их лечат в Германии, во Франции. Национальные руководства различаются несущественно, лечение проводится по одним протоколам. У нас появилась возможность использовать новейшие зарубежные лекарственные препараты, накапливать опыт лечения этими препаратами. Вступление в ВТО приведет к тому, что фармацевтический рынок наполнится огромным количеством новых препаратов. Выбор – это хорошо, новинки – это дорого. Как быть?
В Германии, например, существенную долю назначения и лечения новейшими, дорогостоящими препаратами контролирует государство через страховые кассы, принимая на себя часть расходов. В свою очередь, мы составили региональную программу финансирования лечения суперсовременными дорогостоящими препаратами определенной категории пациентов разных возрастных категорий – от детей до взрослых. Программа была представлена губернатору, а сейчас рассматривается в Департаменте здравоохранения администрации Приморского края. Мы работаем вместе с представителями Комитета по здравоохранению и социальной политике Законодательного собрания Приморского края, взаимодействуем с Обществом пациентов с ревматическими болезнями. Мы не ждем милости «сверху», а активно предлагаем властям искать возможности помочь нашим пациентам.
– Смотрите ли сериалы о врачах? Есть в них правда жизни или изображаемый в них мир существует, в основном, в сознании сценаристов и режиссеров?
– Я бы сказал, что это не настоящие сериалы о врачах, а такие скейч-шоу юмористического плана. Лучшие из зарубежных – сериалы «Скорая помощь» и «Доктор Хаус». Но и в них многое не профессионально, «режет глаз», потому что знаешь, что в жизни так не бывает.
Подобный сериал пытались запустить на Первом канале, он назывался «Доктор Тырса», с Михаилом Пореченковым в главной роли. Но эта попытка почему-то быстро завершилась.
– И последний вопрос: какой подарок вам хочется получить?
–Супероснащенную клинику, с возможностью проводить сложнейшие фундаментальные исследования. Удовлетворение от своей работы, от спасенных жизней, от хороших дел, которые тебе удались, от того, что ты смог передать людям, наверное, самое высокое удовольствие в этой жизни.
Беседовала Анастасия КУЛИКОВА
Инструкция по применению
«Липидомарин»
Биологически активная добавка к пище
Форма выпуска: желатиновые капсулы содержащие 90, 180 или 360 мг чистых алкилглицеридов. Капсулы расфасованы в банки из полимерных материалов по 30, 60 или 90 штук.
Алкилнлицериды выделены из липидов печени кальмара.
Область применения: В мировой медицинской практике алкилглицериды применяются в реабилитационной терапии при лечении раковых заболеваний, при радио- и химио- терапии, усиливая гематопоэз и иммунный ответ организма. Рекомендуется при иммунодефицитных состояниях, воспалениях различной этиологии, инфекционных заболеваниях.
Рекомендации по применению: 4 капсулы по 90мг или 2 по 180мг 1 по 360мг в день перед едой. Продолжительность приема неограниченна.
Срок годности: 2 года с даты изготовления.
Условия хранения: Хранить в закрытой упаковке при комнатной температуре.
Нормативные документы: ТУ 9281-008-02698223-10
Свидетельство о государственной регистрации № 77.99.11.3.У.2114.4.10 от 07.04.2010г.
Адрес изготовителя: ООО «Биополис», Институт биологии моря им. А.В.Жирмунского ДВО РАН, Россия, 690041, г.Владивосток, ул Пальчевского 17, тел. (423) 2-31-09-05.

Скачать полную версию: АГЭ-1968-Arch Int Pharm

Скачать полную версию: АГЭ-1972-Snyder-Mangold